
【题目】孔雀石主要含Cu2(OH)2CO3 , 还含少量FeO、SiO2 . 以孔雀石为原料可制备CuSO45H2O步骤如下: 
(1)写出孔雀石与稀硫酸反应的化学方程式: , 为了提高原料浸出速率,可采取的措施有(写出两条).
(2)溶液A的金属离子有Cu2+、Fe2+ . 实验步骤中试剂①最佳选(填代号)
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是 .
(4)常温下Fe(OH)3的Ksp=1×10﹣39 , 若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10﹣3mol/L,必需将溶液pH调节至 .
(5)由溶液C获得CuSO45H2O晶体,需要经、和过滤.
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO410.00ml,A溶液中Fe2+的物质的量浓度mol/L.
(反应原理:MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O)
【答案】
(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等均可
(2)c
(3)调pH值,(或减少c(H+),)使Fe3+沉淀完全
(4)2
(5)蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶
(6)0.025
【解析】解:孔雀石主要含Cu2(OH)2CO3 , 还含少量Fe、Si的化合物,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,Fe+H2SO4=FeSO4+H2↑,硅和稀硫酸不反应,溶液A只含Cu2+、Fe2+两种金属离子,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2、H2 , 向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3 , 以及过量的试剂,溶液C为硫酸铜溶液,所以为试剂②为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3 , (1)碱式碳酸铜为碱式盐能与稀硫酸反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,生成硫酸铜、水和二氧化碳,为了提高原料浸出速率,可采取的措施有增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等,所以答案是:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等;(2)Fe2+具有还原性,可被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,与KSCN不反应,加入氢氧化钠溶液可生成氢氧化铁、氢氧化铜沉淀而不能检验Fe2+ , 双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+ , 但无明显现象,只有b正确,所以答案是:c;(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质,所以答案是:调pH值,(或减少c(H+),)使Fe3+沉淀完全;(4)常温下Fe(OH)3的Ksp=1×10﹣39 , 使溶液中c(Fe3+)=1×10﹣3mol/L,则c(OH﹣)= ![]() mol/L=1×10﹣12mol/L,所以溶液中c(H+)=1×10﹣2mol/L,则pH=2,所以答案是:2;(5)CuSO45H2O晶体,在高温时易失去水,所以从溶液中获得CuSO45H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,所以答案是:蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶;(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4﹣被还原为Mn2+ , 最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4﹣~5Fe2+ , 用去 KMnO4的物质的量为10.00mL×0.010mol/L=1.0×10﹣4mol,所以A溶液中Fe2+浓度为
mol/L=1×10﹣12mol/L,所以溶液中c(H+)=1×10﹣2mol/L,则pH=2,所以答案是:2;(5)CuSO45H2O晶体,在高温时易失去水,所以从溶液中获得CuSO45H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,所以答案是:蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶;(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4﹣被还原为Mn2+ , 最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4﹣~5Fe2+ , 用去 KMnO4的物质的量为10.00mL×0.010mol/L=1.0×10﹣4mol,所以A溶液中Fe2+浓度为 ![]() =0.025mol/L,所以答案是:0.025.
=0.025mol/L,所以答案是:0.025.


科目:高中化学 来源: 题型:
【题目】某有机物A与氢气的相对密度是38,取有机物A 7.6g完全燃烧后,生成0.2molCO2和0.2molH2O.此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应.下列有关A的说法中不正确的是( )
A.A的分子式为C2H4O3
B.A的结构简式为HO﹣CH2﹣COOH
C.A分子中的官能团有两种
D.1 mol A与足量的单质Na反应时放出H2的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验HCl气体中是否混有Cl2,可采用的方法是
A. 用干燥的蓝色石蕊试纸 B. 用干燥的有色布条
C. 将气体通入硝酸银溶液 D. 用湿润的淀粉-碘化钾试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
(1)咖啡酸的化学式是其中含氧官能团的名称为、 .
(2)咖啡酸可以发生的反应是(填写序号).
①水解反应 ②加成反应 ③酯化反应 ④消去反应
(3)1mol咖啡酸与浓溴水反应时最多消耗mol Br2 .
(4)咖啡酸与NaHCO3溶液反应的方程式
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4 , 该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为 , 咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.10mol·L-1Na2CO3溶液25mL 用0.10mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( ) 
A.a点:c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)
)>c(OH-)
B.b点:5c(Cl-)>4c(HCO![]() )+4c(CO
)+4c(CO![]() )
)
C.c点:c(OH-)=c(H+)+c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
D.d点:c(H+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应为2X(g) ![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
下列推断正确的是( )。
A.升高温度,该反应平衡常数K减小
B.压强大小有P3>P2>P1
C.平衡后加入高效催化剂使气体相对分子质量增大
D.在该条件下M点X平衡转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的( )
A.次氯酸钠溶液中通入少量二氧化硫气体:2ClO﹣+SO2+H2O═2HClO+SO ![]()
B.向NaAlO2溶液中通过量CO2:AlO ![]() +CO2+H2O═Al(OH)3↓+CO
+CO2+H2O═Al(OH)3↓+CO ![]()
C.电路板腐蚀液中的反应:Cu+2Fe3+═2Fe2++Cu2+
D.小苏打溶液与NaOH溶液混合:HCO ![]() +OH﹣═CO2↑+H2O
+OH﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷和丙烯混合物共m mol,与n mol的氧气点燃后完全反应,得到CO和CO2的混合气体,以及63g水.试求:
①当m=1时,丙烷和丙烯的质的量之比: .
②当m=1时,且反应后CO和CO2混合气体物质的量是反应前氧气的物质的量的 ![]() 时,则n=;
时,则n=;
③m的取值范围是:;
④n的取值范围是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: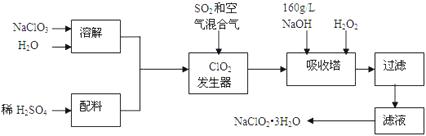
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO23H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中发生反应的离子方程式为。发生器中鼓入空气的作用可能是。
a.将SO2氧化成SO3 , 增强酸性 b.将NaClO3还原为ClO2 c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为;吸收塔内的温度不能超过20℃,其目的是。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com