
����Ŀ����ij��ͭ��ʯ[��Ҫ�ɷ���FeCuSi3O13(OH)4��������SiO2��CaCO3]Ϊԭ���Ʊ�CuSO4��5H2O���������£�

��֪����Լ��ɷֺͼ۸����±���ʾ��

��ش��������⣺
��1����ͭ��ʯ�����Ŀ����_______��
��2����������Һ�г���Cu2+�⣬�����еĽ�����������_______��
��3������1����NaOH��Һ�����ӷ���ʽΪ__________��
��4�����������Ϣ��֪����ѡ�õ��Լ�1������Ϊ_______��������Լ�ʱ��������Ӧ�����ӷ���ʽΪ_________��
��5���Լ�2 ����ѡ����������е�______������2��һ�����е�����Ϊ______(�ѧʽ����
A. Cu B.CuO C.Cu(OH)2 D.Fe
��6��CuSO4��5H2O���ڵ�⾫��ͭʱ��������ͨ��9.632��103C�ĵ�������������ܽ��ͭΪ16.0g�����������Һ��ԭ��ҺΪ1 L����ǡ����CuSO4����������������������_____g��ԭ���Һ��CuSO4��Ũ��Ϊ__ ����֪һ�����ӵĵ���Ϊ1.6��10-19C��
���𰸡� ��ߺ�ͭ��ʯ�������ʼ����Ч�� Fe2+ SiO2+2OH-=SiO32-+H2O ƯҺ ClO-+2Fe2++2H+=Cl-+2Fe3++H2O BC Fe(OH)3 32.0 0.25mol/L
����������ʯ�����������ϡ���ᷴӦ����ͭ��ת��Ϊ�����Σ����������̼��Ʊ�Ϊ����1�������ڸ����·�Ӧת��Ϊ����ƣ�Ҫ�õ�����ͭ������Ҫ��ȥ��Һ�е��������ӣ������������ӵĻ�ԭ�Լ���������ת��Ϊ�����ӣ�ͨ������pHת��Ϊ�����������������˼��õ�����ͭ��Һ���ݴ˷������
��1����ͭ��ʯ�����������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ���Ŀ������ߺ�ͭ��ʯ�������ʼ����Ч�ʣ���2�����������۴�����Ϊ0��֪FeCuSi3O6(OH)4����Ԫ�صĻ��ϼ��ǣ�2�ۣ������������Һ�г���Cu2+�⣬�����еĽ�����������Fe2+����3������1�к��ж������裬����NaOH��Һ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O����4�����������Ϣ��֪ƯҺ�ļ۸���ã������ѡ�õ��Լ�1������ΪƯҺ��������Լ�ʱ���ݵ��ӵ�ʧ�غ��ԭ���غ��֪������Ӧ�����ӷ���ʽΪClO-+2Fe2++2H+=Cl-+2Fe3++H2O����5���Լ�2��Ϊ�˵���pH���������ӣ��õ�����������ͭ��Һ����˿���ѡ������ͭ��������ͭ����ѡBC������2��һ�����е�����ΪFe(OH)3����6��ͨ�����ӵĸ�����9.632��104C��1.6��10-19C��6.02��1023�����ʵ�����1mol������Cu2����2e����Cu��֪������������������![]() �������ܽ��ͭ��16g��64g/mol��0.25mol��������Һ������ͭ�����ʵ�����0.5mol-0.25mol=0.25mol����Ũ����0.25mol��1L��0.25mol/L��
�������ܽ��ͭ��16g��64g/mol��0.25mol��������Һ������ͭ�����ʵ�����0.5mol-0.25mol=0.25mol����Ũ����0.25mol��1L��0.25mol/L��


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��пƬ����Ƭ����ϡ���������ԭ��أ����缫������һ����������
пƬ�Ϸ����ĵ缫��Ӧ��__________________����Ƭ�Ϸ����ĵ缫��Ӧ��_________________��
(2)���õ�������缫��������Ϊ60 g������һ��ʱ���ȡ��пƬ����Ƭϴ���������أ�������Ϊ47 g���Լ��㣺
�ٲ������������(��״��)___________L��
��ͨ�����ߵĵ���________C��(��֪NA��6.02��1023mol��1�����ӵ��Ϊ1.60��10��19C)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 mL 5 mol��L��HCl��Һϡ�͵�200 mL������ȡ��5 mL����5 mL��Һ�����ʵ���Ũ��Ϊ��������
A. 0.5 mol��L B. 0.25 mol��L C. 0.1 mol��L D. 1 mol��L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-(��ɫ)+H2O![]() 2CrO42-(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ�飺
2CrO42-(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ�飺

���ʵ�飬����˵������ȷ����
A. ������Һ��ɫ���������Һ���
B. ����Cr2O72-��C2H5OH��ԭ
C. �Ա���������֪K2Cr2O7������Һ������ǿ
D. �������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L��0.01 mol NaAlO2��0.02 mol NaOH����Һ�л���ͨ��CO2����n(CO2)�����Ⱥ���������ͬ�ķ�Ӧ����0.01 mol<n(CO2)![]() 0.015ʱ�����ķ�Ӧ�ǣ�2NaAlO2+ CO2+3H2O=2Al(OH)3��+Na2CO3�����ж�Ӧ��ϵ��ȷ����
0.015ʱ�����ķ�Ӧ�ǣ�2NaAlO2+ CO2+3H2O=2Al(OH)3��+Na2CO3�����ж�Ӧ��ϵ��ȷ����
ѡ�� | n(CO2)/mol | ��Һ�����ӵ����ʵ���Ũ�� |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)>c(HCO3-)> c(OH-)>c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Cu�ĺϽ�2.64�ˣ�Ͷ��������ϡHNO3��ǡ�÷�Ӧ������ȫ���ܽ�ʱ���ռ��Ļ�ԭ����ΪNO�����Ϊ0.896L (SPt)����Ӧ�����Һ�м���2mol/L NaOH��Һ60mLʱ����������ǡ����ȫ���������γɳ���������Ϊ
A. 4.32�� B. 4.68�� C. 5.36�� D. 6.38��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ҽҩ��ʯ����ҵ���й㷺��;����ͼ��ģ�ҵ�Ʊ��������Ʒ�����Ƶ����̡�
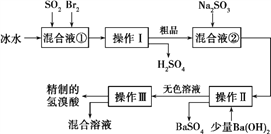
�����������̻ش���������:
��1�����Һ���з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
��2�������Ƚ���γ�BrCl,BrCl��������±�ص������ơ���BrCl��ˮ������Ӧ�Ļ�ѧ����ʽΪ___________________��
��3������Ba(OH)2��Ӧ�����ӷ���ʽΪ______________�������������______��������һ�������ڷ���______����(ѡ����)
a�������Һ�� b��������� c���������ܵ�Һ�� d�����ܵ�Һ��
��4��������������ӦΪ��ɫҺ�壬��ʵ�ʹ�ҵ�������Ƶõ�������(��ҵ������)�����е����Ļ�ɫ�����Ǽס�����ͬѧ����˼�ʵ�����̽������ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ����F![]() ,������֤���ü������õ��Լ�Ϊ______����Ӧ�����ӷ���ʽΪ_____________��
,������֤���ü������õ��Լ�Ϊ______����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CH4��H2O(g)������Ӧ��CH4(g)+H2O(g)![]() CO(g)+3H2(g)������ʼ
CO(g)+3H2(g)������ʼ![]() =Z���ں�ѹ�£�ƽ��ʱ
=Z���ں�ѹ�£�ƽ��ʱ![]() (CH4)�����������Z��T(�¶�)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
(CH4)�����������Z��T(�¶�)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A���÷�Ӧ���ʱ䦤H>0
B��ͼ��Z�Ĵ�СΪa>3>b
C��ͼ��X���Ӧ��ƽ��������![]() =3
=3
D���¶Ȳ���ʱ��ͼ��X���Ӧ��ƽ���ڼ�ѹ��![]() (CH4)��С
(CH4)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�ı��������ǣ� ��
A.������һ�ֽ����Եķ�ɢϵ
B.�������Ӵ����
C.��������ֱ����1��100nm֮��
D.����ͨ������ʱ�ж����ЧӦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com