
【题目】下列事实不能作为判断非金属性强弱依据的是
A. 单质的熔点、沸点高低
B. 非金属之间发生的置换反应
C. 非金属与氢气生成气态氢化物的难易程度
D. 非金属元素的最高价氧化物对应的水化物的酸性强弱
科目:高中化学 来源: 题型:
【题目】2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)在pH=1的水溶液中,一定大量共存的是_____(填序号)
①NH4+、Al3+、Br-、SO42-
② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-
④K+、Na+、HCO3-、SO42-
(2)在下列反应中,水仅做氧化剂的是______(填字母,下同),水既不做氧化剂又不做还原剂的是________.
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
(3)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8L饮用水时,电池内转移的电子数为___________.(NA表示阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)NaCN为剧毒无机物。某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:

实验Ⅰ.硫代硫酸钠晶体(Na2S2O35H2O)的制备
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S![]() Na2S2O3
Na2S2O3
(1)将硫化钠和碳酸钠按反应要求的比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在蒸馏烧瓶中加入亚硫酸钠固体,在分液漏斗中注入_____________(填以下选择项的字母),并按上图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
从以上反应可知Na2S 与Na2CO3的最佳物质的量比是___________________。
(2)pH小于7即会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液中pH接近或不小于7时,即可停止通气和加热。如果SO2通过量,发生的化学反应方程式为____________________.
(3)从上述生成物混合液中获得较高产率Na2S2O35H2O的歩骤为

为减少产品的损失,操作①为趁热过滤, 操作②是________;操作③是抽滤、洗涤、干燥。
Ⅱ.产品纯度的检测
已知:Na2S2O35H2O的摩尔质量为248g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品ag,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是______________
Ⅲ.有毒废水的处理化学兴趣小组的同学在配备防毒口罩,橡胶手套和连衣式胶布防毒衣等防护用具以及老师的指导下进行以下实验:
向装有2ml0.1mol/L 的NaCN溶液的试管中滴加2ml0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但没有明显实验现象,取反应后的溶液少许滴入盛有10ml0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 按系统命名,有机物CH3CH(C2H5)CH(CH3)2的名称是 ( )
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷
C.3,4-二甲基戊烷 D.2,3-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 。
(2)表中元素原子半径最大的是(写元素符号) 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 。Q与水反应的化学方程式为 。
(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热
B. 不用稀硫酸,改用98%的硫酸
C. 滴加少量CuSO4溶液
D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
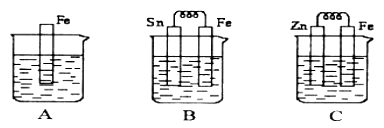
(1)B中Sn极上出现的现象________________;
(2)C中Zn片上的电极反应式为____________________;
(3)A、B、C中铁溶解的速率由快到慢的顺序是_______________。
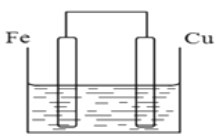
Ⅱ(4)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为_______________。
Ⅲ下图是一个化学过程的示意图,回答下列问题:
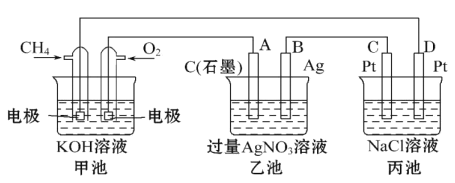
(5)甲装置中通入CH4的电极反应式为_____________________,
(6)从能量转化的角度分析,乙池是_____转化为_________的装置。
(7 )一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为________________。(己知:NaCl溶液足量,电解后溶液体积为500 mL)。
(8)若要使丙池恢复电解前的状态,应向丙池中通入_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为 ;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为 。
(2)工业上常用“水煤气法”获得CO和H2,其反应原理如下:
C(s) + H2O(g) ![]() CO(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2(g) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
某水煤气样品中含0.2LCO、0.5LCO2,则该样品中含H2 L。
(3)工业上还可以通过下列途径获得H2,其中节能效果最好的是 。
A. 高温分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O![]() 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(4)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。
CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。

① 从反应开始到平衡,氢气的平均反应速率v(H2)= mol·(L·min)—1。
② 能够判断该反应达到平衡的是 (填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(5)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com