
【题目】2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)在pH=1的水溶液中,一定大量共存的是_____(填序号)
①NH4+、Al3+、Br-、SO42-
② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-
④K+、Na+、HCO3-、SO42-
(2)在下列反应中,水仅做氧化剂的是______(填字母,下同),水既不做氧化剂又不做还原剂的是________.
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
(3)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8L饮用水时,电池内转移的电子数为___________.(NA表示阿伏加德罗常数的数值)
【答案】(1)①③;(2)CD,B;(3)200NA。
【解析】
试题解析:(1)pH=1,说明溶液显酸性,①能够大量共存,故正确;②NO3-在酸性条件下具有强氧化性,能把Fe2+氧化成Fe3+,不能大量共存,故错误;C、能够大量共存,故正确;④HCO3-+H+=H2O+CO2↑,不能大量共存,故错误;(2)A、根据化合价的变化,-2价O变为0价,化合价升高,被氧化,H2O作还原剂;B、Na2O2中O自身发生氧化还原反应,H2O既不是氧化剂也不是还原剂;C、H2O中H+1→0,化合价降低,被还原,H2O作氧化剂;D、H2O中H的化合价降低,作氧化剂;水仅做氧化剂的是CD,既不是还原剂又不是氧化剂的是B;(3)负极反应式:H2+2OH--2e-=2H2O,正极反应式:O2+2H2O+4e-=4OH-,总电极反应式为:2H2+O2=2H2O,生成n(H2O)=1.8×1000/18mol=100mol,则转移电子的物质的量为n(e-)=2×100mol=200mol,即电子数为:200NA。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(15分)某探究小组以硫酸和铜为原料设计如下四种制备硫酸铜晶体的路线:

请回答下列有关问题:
(1)甲方案中第一步发生反应的化学方程式为___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用废铜、废酸(含HNO3、H2SO4)为主要原料制备硫酸铜晶体,某含有c(HNO3)=2molL-1,c(H2SO4)=4molL-1的废酸混合液100mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4 5H2O)的质量为___________。
(4)丙方案中灼烧时,应在________中进行(填仪器名称),该实验中的后续操作指的是____________。
(5)丁方案中X可以是试剂,也可以是反应条件:
①若X为试剂,该反应的化学方程式为__________________。
②若X为反应条件,即通电,在虚线框中画出该实验设计图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化
物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
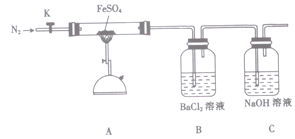
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却。
(2)已知M中铁元素的质量分数为70%,M的化学式为__________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验。

(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A →________ →________。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法能达到目的的是
A.用氨水除去试管内壁上的银镜
B.用分液的方法分离乙酸乙酯和乙醇的混合物
C.用点燃的方法鉴别乙醇、苯和四氯化碳
D.用溴水鉴别苯、甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是MgSO4、NaCl的溶解度曲线。下列说法正确的是( )
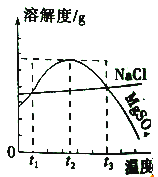
A.MgSO4的溶解度随温度升高而升高
B.NaCl的溶解度比MgSO4的溶解度大
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氨的实验室制取和性质实验如下:

(1)实验室制取氨气的化学方程式为____。
(2)如图是实验室进行氨气溶于水的喷泉实验装置,下列叙述错误的是____。
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
(3)干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
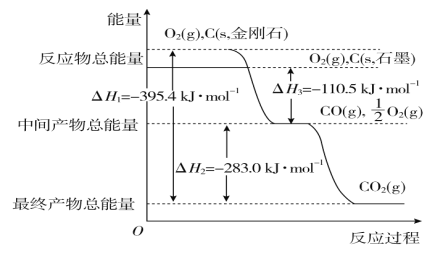
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量的空气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ· mol-1NO分子中化学键的键能为____kJ·mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能作为判断非金属性强弱依据的是
A. 单质的熔点、沸点高低
B. 非金属之间发生的置换反应
C. 非金属与氢气生成气态氢化物的难易程度
D. 非金属元素的最高价氧化物对应的水化物的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com