
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
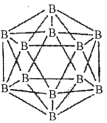
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。

(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
【答案】 2 3 Na<B<H 四面体形 CH4 氢键 范德华力 A sp3 二者均为原子晶体,氮原子的半径小于磷原子, N-B 键的键长小于 P-B 键, N-B 键的键能大 ![]()
![]()
【解析】试题分析:(1)①同一个轨道中的电子自旋相反。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B分析电负性,根据价电子理论分析BH4-离子的空间构型,等电子体是原子数相同、价电子数也相同的微粒。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键。B与Si的性质符合对角线原则。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P。
(5)己知磷化硼的晶胞参数a=478 pm,根据![]() 计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() )。478 pm
)。478 pm![]()
![]()
解析:(1)①同一个轨道中的电子自旋相反,B原子核外电子排布为1S22S22P1,核外存在2对自旋相反的电子。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B,,所以电负性Na<B<H,根据价电子理论BH4-离子的价电子对数是![]() ,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键,硼酸晶体中存在的作用力有共价键、分子间作用力、氢键。B与Si的性质符合对角线原则,所以与H3BO3酸性最接近的是H4SiO4。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P,所以立方相氮化硼晶体的熔点要比磷化硼体高。
(5)根据均摊原则1个晶胞含有一个晶胞含有4个B,4个P,设有1mol晶胞,则体积为![]() ,质量为42
,质量为42![]() g,根据
g,根据![]() ,晶体的密度为
,晶体的密度为![]() =
=![]() 。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() ),所以晶胞中硼原子和磷原子最近的核间距为
),所以晶胞中硼原子和磷原子最近的核间距为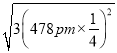 =
=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钛(![]() )被称为继铁、铝之后的第三金属,钛白(
)被称为继铁、铝之后的第三金属,钛白(![]() )是目前使用最广泛的白色颜料。制备
)是目前使用最广泛的白色颜料。制备![]() 和
和![]() 的原料是钛铁矿,用含
的原料是钛铁矿,用含![]() 的钛铁矿(主要成分为
的钛铁矿(主要成分为![]() )制备
)制备![]() 的流程如下:
的流程如下:
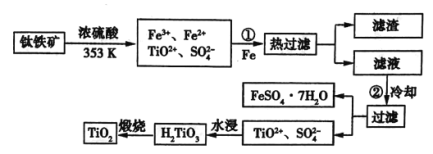
(1)步骤①加![]() 的目的是__________________;步骤②冷却的目的是_____________。
的目的是__________________;步骤②冷却的目的是_____________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入______________处理。
(3)由金红石(![]() )制取单质钛(
)制取单质钛(![]() )的过程为
)的过程为![]() ,其中反应
,其中反应![]() 在氩气气氛中进行的理由是____________。
在氩气气氛中进行的理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
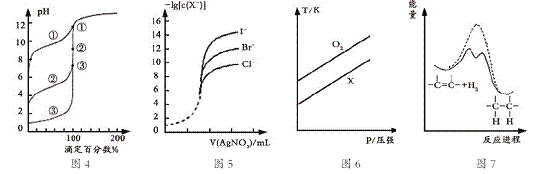
A.用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C.在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D.由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A. v(A)=0.15molL﹣1s﹣1B. v(B)=0.6molL﹣1s﹣1
C. v(C)=0.5molL﹣1s﹣1D. v(D)=0.4molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种钯催化的交叉偶联反应可以表示为:

硝基还原为氨基: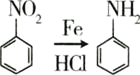
下面是利用钯催化的交叉偶联反应,以烯烃A(含两个甲基)与苯为原料合成L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。

(1)写出反应的反应类型:④___⑥___。
(2)写出反应需要的无机反应物、反应条件:①___⑤___;
(3)J中所含官能团的名称__,__。
(4)根据要求完成下列两个空格:
用系统命名法给物质A命名:__;写出物质L的结构简式:__。
(5)写出下列反应的化学方程式:
C→D:___。
D与新制的Cu(OH)2__。
F→G:___。
(6)H有多种同分异构体,请写出一种符合下列条件的结构简式:__。
ⅰ.能发生水解反应
ⅱ.分子中只含有两个甲基
ⅲ.不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯(![]() )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:据此回答下列问题:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:据此回答下列问题:
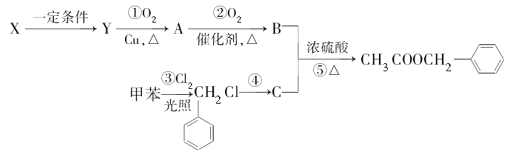
(1)C的名称为___。
(2)反应④所需的条件是___。
(3)X生成Y的化学方程式为__,该反应的反应类型为__。请写出反应⑤的化学方程式__。该反应的反应类型为___。检验A中存在的官能团时所发生的应的化学方程式为__。
(4)上述反应①~⑤中原子的理论利用率为100%、符合绿色化学要求的反应是__(填序号)。
(5)写出符合下列条件的乙酸苯甲酯的一种同分异构体的结构简式:①含苯环结构;②具有酯的结构③能发生银镜反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是
A. 滴定终点时,溶液变为红色
B. 该滴定法需在碱性条件下进行
C. AgBr(s)+SCN-![]() AgSCN(s)+Br-(aq)的平衡常数K=0.77
AgSCN(s)+Br-(aq)的平衡常数K=0.77
D. 该水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com