
【题目】一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)![]() xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.

下列有关说法中正确的是
A. x=2,反应开始2 min内,v(A)=0.05molL﹣1min﹣1
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】苏联科学家欧巴林教授在其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳和水开始的。与之相关的转化关系如图所示(部分反应条件已略去):

(1)A的结构式为________;C中官能团的电子式为________;反应②的反应类型为________。
(2)写出下列物质的结构简式:D________;H________。
(3)C→D的化学方程式为__________;二氧化碳和水经光合作用生成葡萄糖的化学方程式为_________。
(4)在自然界中纤维素与水可在甲烷菌的催化作用下生成甲烷和二氧化碳,写出该反应的化学方程式并配平:
_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
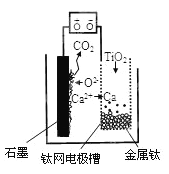
A. 将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B. 阳极的电极反应式为:C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 石墨为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。平衡常数如下表:下列说法正确的是( )
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油和煤可以得到有机化工生产中需要的众多原料,如由石油裂解得到的乙烯和由煤干馏得到的苯制聚苯乙烯。生产过程如下:
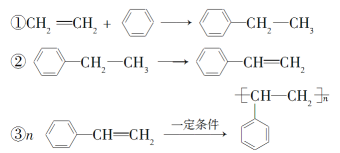
下列说法不正确的是( )
A. 通过裂解可以从石油中获得很多重要的化工原料
B. 将煤干馏不能直接得到纯净的苯
C. 制聚苯乙烯的反应①为加成反应,反应②为消去反应
D. 反应①②③的原子利用率都达到了100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述你认为合理的是
A.放热反应是反应物总能量低于生成物总能量的反应
B.吸热反应是指需要加热才能发生的反应
C.断裂化学键需要释放能量,形成化学键需要吸收能量
D.化学反应不仅有物质的变化,而且还伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
选项 | 酸 | 碱 | 碱性氧化物 | 盐 |
A | H2CO3 | 纯碱 | CaO | 明矾 |
B | H2SO4 | 烧碱 | Na2O | 小苏打 |
C | HNO3 | 氨水 | Al2O3 | 石灰石 |
D | NaHCO3 | 熟石灰 | Al(OH)3 | 食盐 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com