
【题目】中学化学中几种常见物质的转化关系如图K8﹣4所示.将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.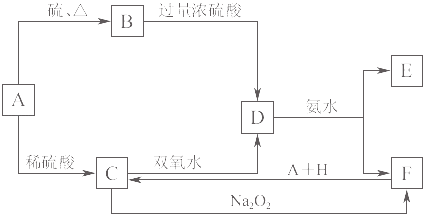
请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: .
(2)A,B,H的化学式:A、B、H .
(3)①H2O2分子的电子式为 .
②写出C的酸性溶液与双氧水反应的离子方程式: .
(4)写出鉴定E中阳离子的实验方法和现象: .
(5)在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式: .
【答案】
(1)1nm﹣100nm
(2)Fe,FeS,H2SO4
(3)![]() ,2Fe2++H2O2+2H+═2Fe3++2H2O
,2Fe2++H2O2+2H+═2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝
(5)4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+
【解析】解:将D溶液滴入沸水中可得到以F为分散质的红褐色液体,说明F为Fe(OH)3;证明D为硫酸铁,E为硫酸铵;由转化关系可知,C为硫酸亚铁,推断A为Fe;B为FeS,转化关系中F(Fe(OH)3)+H+A(Fe)=C(FeSO4),推断H为硫酸;根据判断出的物质回答问题:综上所述各物质为:A、Fe;B、FeS;C、FeSO4;D、Fe2(SO4)3;E、(NH4)2SO4;F、Fe(OH)3;H、H2SO4;
(1)红褐色液体是氢氧化铁胶体,分散质粒子直径大小的范围是1nm﹣100nm,
所以答案是:1nm﹣100nm;
(2)依据推断可知A为Fe,B的化学式为:FeS,H为H2SO4;
所以答案是:Fe,FeS,H2SO4;
(3)①分析判断H2O2是共价化合物,分子的电子式为: ![]() ;
;
所以答案是: ![]() ;
;
②C的酸性溶液与双氧水反应,是FeSO4的溶液(A→C稀硫酸过量)与双氧水在酸性溶液中反应,亚铁离子被过氧化氢氧化为三价铁,过氧化氢被还原为水,离子方程式:
2Fe2++H2O2+2H+═2Fe3++2H2O,
所以答案是:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)E中有铵根离子,可取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝,说明有铵根离子,
所以答案是:取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝;(5)在C(FeSO4)溶液中加入与C等物质的量的Na2O2,恰好使C转化为F(Fe(OH)3),反应的离子方程式为:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+;
所以答案是:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+;


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
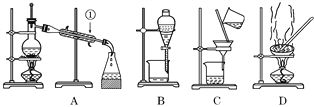
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填字母,下同);除去自来水中的可溶性物质,选择装置__________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________________。
(3)装置A中①中水的进出方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠投入滴有石蕊的水中,下列现象叙述错误的是( )
A. 水溶液变为红色 B. 钠熔成闪亮的小球并在水面四处游动
C. 钠浮在水面 D. 有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中充入2molNO2 , 一定温度下建立如下平衡:2NO2 ![]() N2O4 , 此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4 , 在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
N2O4 , 此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4 , 在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
A.x>y
B.x<y
C.x=y
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O (g)+CO(g)H2 (g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2 . 在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,则反应达平衡后,求:
(1)达平衡后CO的转化率
(2)混合气体中CO2体积分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠与水的反应是中学化学中的一个重要反应。高一化学教材中该实验曾出现过几种不同的演示方法。分别如下图中(A)(B)(C)所示:

(1)现按图(A)所示的方法,在室温时,向盛有饱和Na2CO3溶液(滴有几滴酚酞)的烧杯中,加入一小块金属钠。
①不可能观察到的现象是___________(填字母代号)。
A.钠浮在液面上,并四处游动,最后消失
B.反应过程中钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
②按图(B)所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体,在相同条件下体积最大的是______(填字母代号)。
A.用扎有小孔的铝箔包住钠
B.用扎有小孔的铜箔包住钠
C.直接将钠投人水中
(2)按图(C)所示的方法进行该实验,若500mL的矿泉水瓶开始时装有477.6mL水,用手挤压矿泉水瓶至水刚好充满矿泉水瓶并塞紧带有钠的塞子,要使倒置的矿泉水瓶正好恢复原状,假设矿泉水瓶内外均为标准状况,则大头针上扎着的钠粒质量约为_______g。
(3)1998年全国高考试题中的实验题就是根据图(B)的原理设计的。题目及部分答案如下:测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:800毫升烧杯、10毫升量筒、短颈玻离漏斗、长颈漏斗、玻璃棒、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应产生的气体体积不超过100毫升。)
I、补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):

①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。……
[答案]
②往烧杯中注入水,直至水面没过漏斗颈。[评分标准,凡加水改为加酸者,不论其他后续步骤是否正确,本小题一律0分]
③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。
④将“仪器A”插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
回答下列问题:
a.合金样品用用铜网包裹的目的是______________。
b.为什么在“②往烧杯中注入水,直至水面没过漏斗颈”这一步中改加水为加酸会得0分(请写出两条原因):_____________________。
c. “仪器A”可以是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com