
分析 若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-),进而计算c(H+),结合溶液稀释前后溶质的物质的量不变计算该题.
解答 解:若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为$\frac{0.1L×0.05mol/L}{2mol/L}$=0.0025L=2.5mL,
故答案为:2.5.
点评 本题考查难溶电解质的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为94 | B. | 中子数为144 | C. | 质子数为238 | D. | 电子数为144 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
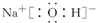 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com