
| A. | 喝大量冷开水 | B. | 喝大量食盐水 | ||
| C. | 喝大量牛奶 | D. | 注射大量葡萄糖水 |
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表的一部分.
如表为元素周期表的一部分.| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
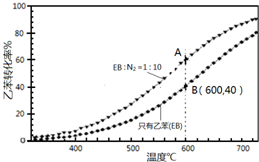 苯乙烯(
苯乙烯(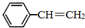 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$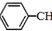 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1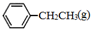 、
、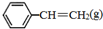 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| 反应物投入量 | 1moN2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
| NH3浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2p1=2p3>p2 | |
| B. | α2+α3<1 | |
| C. | 达到平衡时丙容器中NH3的体积分数最大 | |
| D. | Q1+Q3>92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
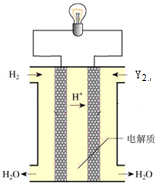
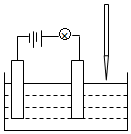 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 醋酸中逐滴加入氢氧化钠溶液 | B. | 硫酸钠中逐滴加入氢氧化钡溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 盐酸中逐滴加入硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 在加热和催化剂作用下,最多能和5mol H2反应 | |
| C. | 能使溴水褪色 | |
| D. | 一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com