
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式__________________________________________
(2)在反应中MnO2发生________(填“氧化”或“还原”)反应。氧化产物为__________
(3)当0.1 mol MnO2参加反应时,转移电子数为____,被氧化的HCl为________mol。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 纯碱溶于热水后去污效果增强,说明升高温度促进了水解,使水解平衡正向移动,所以可以说明纯碱的水解是吸热反应,故A正确;B. 根据△G=△H-T△S可知,当△G小于0时反应自发进行,由于反应NH3(g) + HCl(g) = NH4Cl(s)是熵值减小的反应,所以如果该反应在较低温度下能自发进行,则说明该反应的△H<0,故B错误;C.因合成氨的反应是可逆反应,所以无法确定将7 g N2和3 g H2置于密闭容器中充分反应后,生成了多少NH3(g),故无法计算该反应的焓变,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物时所放出的能量,所以生成的水应为液态,即甲烷燃烧的热化学方程式应表示为CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D错误;答案选A。
【题型】单选题
【结束】
14
【题目】在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸电离,且c(H+)增大,应采取的措施是
A. 加水 B. 升温 C. 加适量CH3COONa固体 D. 通适量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.铁是应用最广泛的金属,铁的卤化物、氯化物以及高价铁的含氧酸盐均为重要化合物。已知氧化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
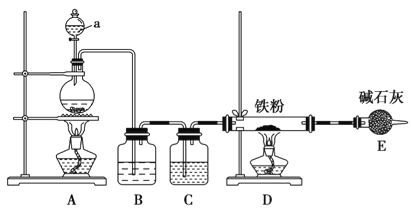
①装置A中发生的离子方程式_______________
②装置B的作用是________,C中的试剂______________。
③实验开始时先点燃___处酒精灯;装置E的作用为__________。
(2)工业上制备无水氯化铁的一种工艺流程如下:
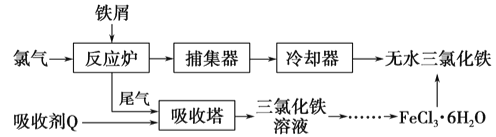
①吸收塔中发生反应的离子方程式为__________
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:____________
Ⅱ.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
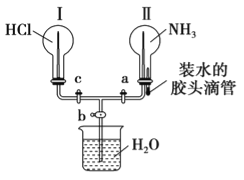
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______。
(2)若先打开a、c活塞,再挤压胶头滴管(假设NH3不能被完全吸收),在烧瓶Ⅱ中可观察到的现象是_____。
(3)通过挤压胶头滴管和控制活塞的开关,要在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是( )
A.热稳定性:H2O>HF>H2SB.最高正化合价:F>N>C
C.酸性:H2CO3>H3PO4>H2SO4D.非金属性:Cl>S>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH )为一元弱碱(25℃时,电高常数Kb=9.0×10-9),其电离方程式为NH2OH+H2O ![]() NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
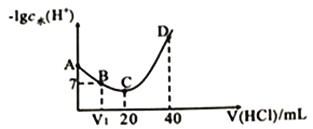
A. V1<10
B. A点对应溶液的pH=9.5
C. A 、B、C 、D四点对应的溶液中NH2OH电离常数相等
D. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要含有CO2 、CO、SO2、NOx 等物质,尾气中CO、氢氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为________________________________。
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 4 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为/span>_________(保留两位有效数字,下同)。
②该反应为________(填“吸热”或“放热”) 反应,实验2条件下的平衡常数K=________。
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是_________________________(用含a、b的数学式表示)。
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为____________。
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醛的说法错误的是( )
A. 一个乙醛子有6个σ键,1个π键
B. 乙醛分子中存在非极性键
C. 乙醛在催化剂铜存在下可以氧化生成乙醇
D. 乙醛晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com