
Ⅰ.已知:4Al(s)+3O2(g) = 2Al2O3(s) △H=-2834.9KJ•mol-1
Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) △H=+234.1KJ•mol-1
CO2(g)+2Fe(s) △H=+234.1KJ•mol-1
C(s)+O2(g)= CO2(g) △H=-393.5KJ•mol-1
写出铝与氧化铁发生铝热反应的热化学方程式______________ 。
Ⅱ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g) △H<0 体系中,n(NO)随时间的变化如表:
2NO2(g) △H<0 体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K= ; 用O2表示从0~2s内该反应的平均速率ν(O2)= 。
(2) 下列研究目的和示意图相符的是 。
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
III.科学家制造出一种使用固体电解质的高效燃料电池。一个电极通入空气,另一个电极通入燃料蒸汽。其中固体电解质是掺杂了Y2O3 的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丙烷(C3H8)代表燃料。
(1) 电池的负极反应式为________________;
(2) 放电时固体电解质里的O2-离子向____极移动(填“正”或“负”)。
科目:高中化学 来源: 题型:
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式为 , Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述中正确的是 ( )
A.CS2为V形分子
B.NCl3的空间构型为平面三角形
C.铝的第一电离能比镁的第一电离能大
D.SiF4和H2O的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)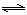 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g) 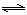 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 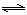 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)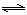 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳
和水蒸气进入反应时,会发生如下反应:
CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随
H2(g)+CO2(g),该反应平衡常数随
温度的变化如右表所示。
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO
 和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、
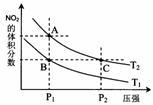
NO2、N2O4等。对反应N2O4(g)  2NO2(g) △H>0在温
2NO2(g) △H>0在温
度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线
 如右图所示。下列说法正确的是 :
如右图所示。下列说法正确的是 :
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
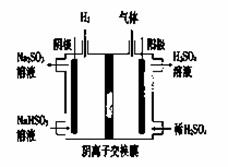
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置
电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的
|
|
| X | Y |
| Z | W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.W的金属性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机实验操作或叙述正确的是
A.将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色
B.鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中
C.苯能使溴水褪色是因为二者反应生成了溴苯
D.工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值,则下列说法中,正确的是
A.常温下,0.1 mol碳酸钠晶体中含有CO2—3的个数为0.1 NA
B.标准状况下22.4LH2O所含分子数为NA
C.1 L0.5 mol·L-1 CH3COOH溶液中,CH3COO—离子的个数为0.5 NA
D.在NO、NO2的混合气体22.4L中,含有的氮原子数为NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com