
 2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)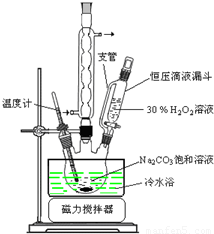
 2H2O+O2↑,有气体生成导致压强改变,应考虑压强;
2H2O+O2↑,有气体生成导致压强改变,应考虑压强; 2H2O+O2↑,有气体生成导致压强增大,如不及时平衡压强,容易产生实验事故,所以支管有平衡压强的作用,故答案为:平衡压强;
2H2O+O2↑,有气体生成导致压强增大,如不及时平衡压强,容易产生实验事故,所以支管有平衡压强的作用,故答案为:平衡压强; =25.50%
=25.50%

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)查看答案和解析>>
科目:高中化学 来源: 题型:
314(m1-
| ||
| 102m1 |
314(m1-
| ||
| 102m1 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第二次联考化学试卷(解析版) 题型:实验题
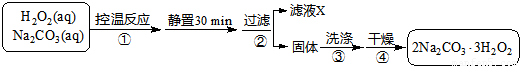
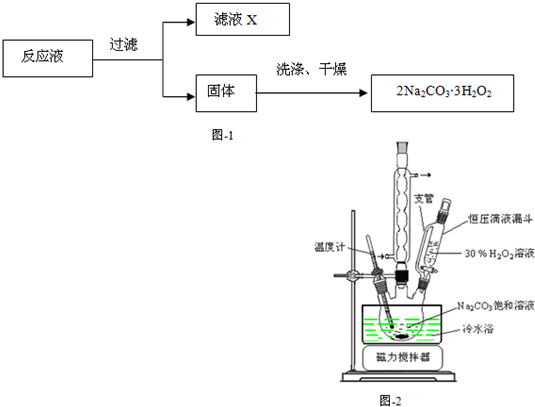
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。
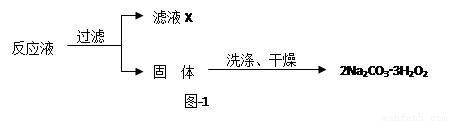
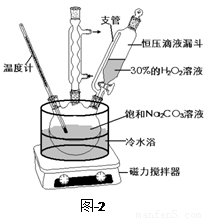
(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
|
实验步骤 |
预期现象与结论 |
|
将气体依次通入盛有_______、________的洗气瓶中,________________________。 |
①________________________ ②________________________ ③________________________ |
查看答案和解析>>
科目:高中化学 来源:2012年浙江省高考调研化学试卷(解析版) 题型:解答题

 2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com