
����Ŀ�������ȣ�SO2Cl2����һ����Ҫ�Ļ����Լ���ʵ���Һϳ������ȵ�ʵ��װ������ͼ��ʾ��
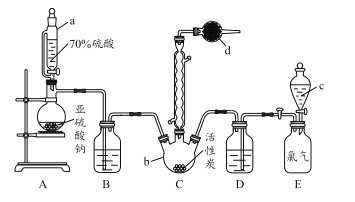
��֪��
��SO2��g��+Cl2��g��![]() SO2Cl2(l) ��H=��97.3 kJ/mol
SO2Cl2(l) ��H=��97.3 kJ/mol
�������ȳ�����Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�������ס����̡���
��100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ��������������
��1������aΪ��ѹ��Һ©��������ͨ��Һ©����ȣ����ŵ���_____________________��
��2������b������Ϊ____________��
��3��װ��A�з�����ѧ��Ӧ�����ӷ���ʽΪ _____________________________��
��4������d��ʢ�ŵ��Լ�Ϊ______��
A����ˮ����ͭ B����ˮ�Ȼ��� C����ʯ�� D������������
��5���Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ___________________������������Һ̬����ķ�����_____________��
��6��װ��EΪ����װ�ã������ṩ���������Һ©��c��ʢ�ŵ��Լ�Ϊ_________����װ��E���ų�����0.224 L��������ɱ�״����ʱ�����յõ�1.08 g�����������ȣ��������ȵIJ���Ϊ_____�����ڴ�ŵ������Ȼᷢ�ƣ���ԭ�����Ϊ_________________��
���𰸡� ƽ���Һ©������ѹǿ������Һ��˳������ ������ƿ 2H��+SO32�� ![]() H2O+SO2�� C 2ClSO3H
H2O+SO2�� C 2ClSO3H![]() SO2Cl2+H2SO4 ���� ����ʳ��ˮ 16% ��������������ֽ����������
SO2Cl2+H2SO4 ���� ����ʳ��ˮ 16% ��������������ֽ����������
������������ʵ�鷽����������ۣ���1������aΪ��ѹ��Һ©��������ͨ��Һ©����ȣ����ŵ���ƽ���Һ©������ѹǿ������Һ��˳�����£���2������bΪ������ƿ����3��װ��AĿ�����Ʊ�SO2�����ӷ�Ӧ����ʽΪSO32����2H��=SO2����H2O����4��SO2���ж����壬�������ڳ�ʪ�������ס����̡������װ��d������������δ��ӦSO2���Լ���ֹ������ˮ��������Cװ�ã���װ��dʢ�ŵ��Ǽ�ʯ�ң���ѡ��C��ȷ����5���Ȼ�����ȷֽ⣬�õ������Ⱥ�����һ�����ʣ�������ΪH2SO4������Ӧ���̷�ʽΪ2ClSO3H![]() SO2Cl2+H2SO4 ��SO2Cl2ΪҺ�壬H2SO4ΪҺ�壬������е㲻ͬ�������������з��룻��6���������ʲ���������������Ӧ������Һ©��c��ʢ�ŵ��Լ�Ϊ����ʳ��ˮ�����������ʵ���Ϊ11.2/22.4mol=0.05mol�����ݷ���ʽ��n(Cl2)=n(SO2Cl2)=0.05mol������������SO2Cl2������Ϊ0.05��135g=6.75g������Ϊ1.08/6.75��100%=16%���������ֽ�ɶ�������������������������������ֽ���������������ơ�
SO2Cl2+H2SO4 ��SO2Cl2ΪҺ�壬H2SO4ΪҺ�壬������е㲻ͬ�������������з��룻��6���������ʲ���������������Ӧ������Һ©��c��ʢ�ŵ��Լ�Ϊ����ʳ��ˮ�����������ʵ���Ϊ11.2/22.4mol=0.05mol�����ݷ���ʽ��n(Cl2)=n(SO2Cl2)=0.05mol������������SO2Cl2������Ϊ0.05��135g=6.75g������Ϊ1.08/6.75��100%=16%���������ֽ�ɶ�������������������������������ֽ���������������ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=lgKa��25��ʱ��H2A �� pKa1=1.85��pKa2=7.19�������£��� 0.1 mol/LNaOH ��Һ�ζ� 20 mL 0.1 mol/LH2A ��Һ�ĵζ�������ͼ��ʾ������˵����ȷ���ǣ� ��
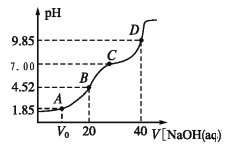
A. A ��������Һ�У�V0��10 mL
B. B ��������Һ�У�c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C ��������Һ�У�c(A2-)= c(Na+)��c(HA-)��c(H2A)
D. D ��������Һ�� A2-ˮ��ƽ�ⳣ�� Kh1=107.19
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�ˮ����ԭ�����ǣ� ��
A.2Na��2H2O=2NaOH��H2��
B.CaO��H2O=Ca(OH)2
C.3NO2��H2O=2HNO3��NO
D.2F2��2H2O=4HF��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ��Ҫ�ķǽ���Ԫ��֮һ����ش������й����⡣
��֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-196.6kJ/mol
2SO3(g) ��H=-196.6kJ/mol
2NO(g)��O2(g)![]() 2NO2(g) ��H=-113.0kJ/mol
2NO2(g) ��H=-113.0kJ/mol
��1����ӦNO2(g)+ SO2(g)![]() SO3(g)+NO(g)�Ħ�H= ______kJ/mol ��
SO3(g)+NO(g)�Ħ�H= ______kJ/mol ��
��2��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� _________��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1 mol SO2��ͬʱ����1 molNO
��3��S2Cl2��SCl2��Ϊ��Ҫ�Ĺ�ҵ�������֪��
a.S2��l��+Cl2��g��![]() S2Cl2��g�� ��H1
S2Cl2��g�� ��H1
b.S2Cl2��g��+ Cl2��g��![]() 2SCl2��g�� ��H2
2SCl2��g�� ��H2
����ѹǿ�£���10 L�ܱ������г���1 molS2Cl2��1 mol Cl2��������Ӧb��Cl2��SCl2���������ʣ��ԣ����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
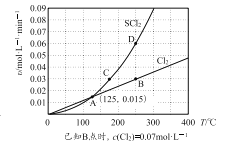
�� A��B��C��D�ĵ��Ӧ״̬�£��ﵽƽ��״̬����______(����ĸ)��������_______��
�ڡ����¶��£��ں����ܱ������з�����Ӧa�ͷ�Ӧb���ﵽƽ�����С�����ݻ������´ﵽƽ���Cl2��ƽ��ת����_________�������С�����䡱����������________��
II�����в�ͬ��̬�Ļ�����簱���������������ơ��Ҷ����ȡ�
ͼ��I����ͼ��II���ֱ�Ϊ��Ԫ��H2A���Ҷ�����H2NCH2CH2NH2����Һ�и����İٷֺ����ģ������ʵ����ٷ���������ҺpH�ı仯���ߣ�25�棩��
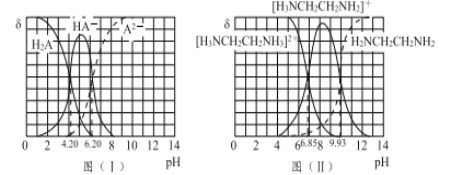
��1��H3NCH2CH2NH3A��Һ��____����ᡱ����ԡ�
��2���Ҷ�����ˮ��Һ�з����ڶ�������ķ���ʽ��____________________����ƽ�ⳣ��Kb2= _______________________ ��
��3����20 mL 0.1 mol/L��H2A��Һ����10 mL 0.1 mol/L H2NCH2CH2NH2��Һ����Һ�и�����Ũ�ȴ�С�Ĺ�ϵΪ ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ӹֹ�ʱ����13755Cs���С�����̽�ˡ�������ġ�137����ָ��ԭ�ӵģ� ��
A.������
B.������
C.������
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʳ����������Ȼ����Ľṹ��ʽ��ͼ��ʾ�����ڸ��л����������������ȷ���ǣ�������
�ٷ���ʽΪC12H20O2
����ʹ����KMnO4��Һ��ɫ
������ͬ���칹�����з����廯����
��1mol���л���ˮ��ʱֻ������1molNaOH
��1mol���л�����һ���������ܺ�3mol H2��Ӧ��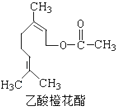
A.�٢ڢ�
B.�٢ڢ�
C.�٢ڢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�����������γɵľ����Ľṹ��ʽΪ ![]() ������������Ϊ���͵IJ;�ԭ�ϣ�����������������������������£���Ѹ�ٷֽ�Ϊ�����ʣ����Խ��⣮�����й��������͵Ŀɽ������ϵ�������ȷ���ǣ�������
������������Ϊ���͵IJ;�ԭ�ϣ�����������������������������£���Ѹ�ٷֽ�Ϊ�����ʣ����Խ��⣮�����й��������͵Ŀɽ������ϵ�������ȷ���ǣ�������
A.����������һ�ִ�����
B.�����������еľۺϷ�ʽ��۱���ϩ����
C.������һ�����߷��Ӳ���
D.����Է�������Ϊ72
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л���A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ1��ʾ��
��1��D�����й����ŵ������� �� �߷��ӻ�����E����������
��2����Ӧ�ڵĻ�ѧ����ʽ������Ӧ�ܵĻ�ѧ����ʽ�� ��
��3��ijͬѧ����ͼ2��ʾ��ʵ��װ����ȡ��������������ʵ��������Թܼ����ϲ�Ϊ���ġ�������ˮ����״Һ�壮
��ʵ�鿪ʼʱ���Թܼ��еĵ��ܲ�����Һ���µ�ԭ������
������ʵ���б���̼������Һ����������
����ʵ��������B��D�Ʊ�����������ʵ���У�����1mol B��1mol D��ַ�Ӧ����������1mol ����������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Ag2O�����һ�ֿ�����ˮ�¶�����������Դ����ԭ����ͼ��ʾ���õ�ع���ʱ�ܷ�ӦʽΪ2Al��3Ag2O��2NaOH=2NaAlO2��6Ag��H2O��������˵��������� (����)��

A. ����ʱ����������ԭ��Ӧ��������������С
B. ���缫������1.08 g Agʱ����·��ת�Ƶĵ���Ϊ0.1 mol
C. Al�缫�ķ�ӦʽΪAl��3e����4OH��=AlO2����2H2O
D. ����ʱ���Һ�е�Na������Ag2O/Ag�缫
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com