
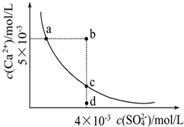
 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
分析 ①处于曲线上的点为饱和溶液的平衡状态;
②Ksp与温度有关,a和c的Ksp相等;
③依据图示读数判断是否有沉淀生成即可;
④蒸发使离子浓度增大,d点不可能到c点;
⑤常温下CaSO4饱和溶液中,c(Ca2+)=c(SO42-);
⑥根据混合后溶液中硫酸根离子的浓度偏低.
解答 解:①处于曲线上的点为饱和溶液的平衡状态,故①正确;
②a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故②错误;
③根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,故③正确;
④升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,不可能由d点变为c点,故④错误;
⑤常温下CaSO4饱和溶液中,c(Ca2+)=c(SO42-),而曲线上的点所表示的c(Ca2+)与c(SO42-),不一定相同,故⑤错误;
⑥常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,混合液中硫酸根离子浓度约为$\frac{0.01mol/L×0.4L}{0.1L+0.4L}$=0.008mol/L,而b点硫酸根离子的浓度为0.004mol/L,则无法使溶液由a点变为b点,故⑥错误;
根据分析可知,正确的有2句,
故选A.
点评 本题考查了沉淀溶解平衡的应用,图象分析应用,溶度积计算分析,平衡移动方向的判断,关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
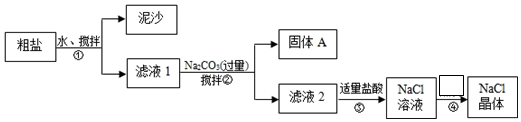
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
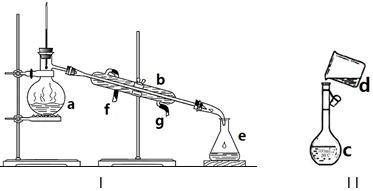
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
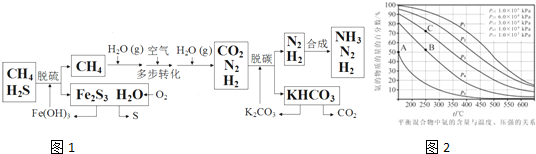
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
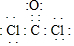
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
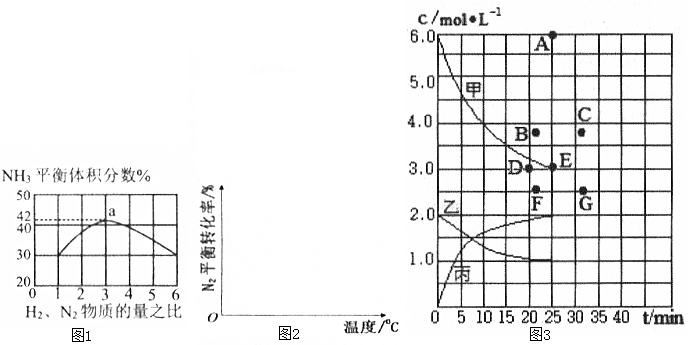

| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com