
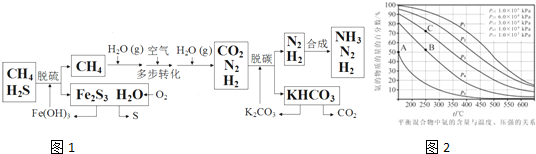
分析 (1)根据流程利用Fe(OH)3与H2S反应生成硫化铁和水从而除去H2S;根据Ksp[Fe(OH)3]=2.6×10-39计算c(Fe3+);
(2)由流程利用空气中氧气氧化硫化铁生成硫单质,根据得失电子守恒计算氧化剂与还原剂的物质的量之比;根据回收硫,则选用的氧化剂不能有毒也不能引入新的杂质判断;
(3)合成氨气的反应为可逆反应,不能完全转化;
(4)平衡常数只随温度变化,图象变化趋势可知随温度升高,氨气含量减小,说明反应逆向进行,所以温度越高平衡常数越小;
依据图象可知A点氨气平衡含量为50%,其中V(N2):V(H2)=1:3,据此计算此时平衡时H2物质的量,再用转化率=$\frac{转化量}{起始量}$×100%计算;
(5)分离生成物促进平衡正向进行提高生产效率.
解答 解:(1)由流程可知,利用Fe(OH)3与H2S反应生成硫化铁和水从而除去H2S,反应方程式为:3H2S+2Fe(OH)3=Fe2S3+6H2O;
又Ksp[Fe(OH)3]=2.6×10-39,所以Fe(OH)3在水中达到溶解平衡时,c(Fe3+)=$\frac{K{\;}_{sp}[Fe(OH){\;}_{3}]}{c(OH{\;}^{-}){\;}^{3}}$=$\frac{2.6×10{\;}^{-39}}{(1×10{\;}^{-7}){\;}^{3}}$mol•L-1=2.6×10-18 mol•L-1;
故答案为:3H2S+2Fe(OH)3=Fe2S3+6H2O;2.6×10-18;
(2)由流程利用空气中氧气氧化硫化铁生成硫单质,氧化剂氧气得4e-,还原剂硫化铁失2×3=6e-,根据得失电子守恒,则氧化剂与还原剂的物质的量之比3:2;因为氯气有毒,KMnO4 会引入新的杂质,所以适宜作此反应的氧化剂的是H2O2和O3;
故答案为:3:2;BD;
(3)因为合成氨气的反应为可逆反应,不能完全转化,所以除流程中Fe(OH)3和K2CO3可循环利用之外,还可循环利用的物质有N2 和H2,故答案为:N2 和H2;
(4)因为平衡常数只随温度变化,图象变化趋势可知随温度升高,氨气含量减小,说明反应逆向进行,所以温度越高平衡常数越小,又A、B、C三点温度为
B=C>A,所以A、B、C三点对应的化学平衡常数KA、KB、KC的关系是KA>KB=KC;
V(N2):V(H2)=1:3,又A点氨气平衡含量为50%,所以设氮气转化为x,
N2+3H2═2NH3,
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
则$\frac{2x}{1-x+3-3x+2x}$×100%=50%,解得x=$\frac{2}{3}$,所以H2的转化率=$\frac{转化量}{起始量}$×100%=$\frac{2}{3}$×100%=66.7%;
故答案为:KA>KB=KC;66.7%;
(5)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,促进平衡正向进行,能提高单位时间内氨的产量,
故答案为:能提高单位时间内氨的产量.
点评 本题以天然气、空气为原料合成氨为信息考查混合物分离提纯综合应用,涉及方程式的书写、化学平衡知识等,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
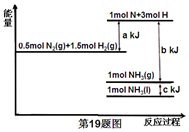
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
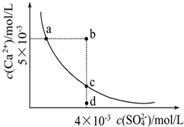 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 平衡时的热量变化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一组 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二组 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K为已知反应的平衡常数,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同温度下,在第二组平衡后的混合气体中再加入2molHI,重新达到平衡后,HI的转化率为21.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
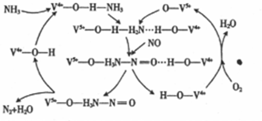

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com