
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图所示。
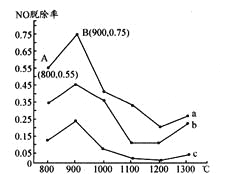
(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
②曲线b对应的NH3与NO的物质的量之比是______,其理由是_________。
(2)已知在25℃,101kPa时:
N2(g)+3H2(g) =2NH3(g) △H=-Q1/mol
2H2(g)+O2(g) =2H2O(1) △H=- Q2kJ/mo1
N2(g) +O2(g) = 2NO(g) △H=+ Q3kJ/mo1
请写出用NH3脱除NO的热化学方程式__________。
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:

(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为__________。
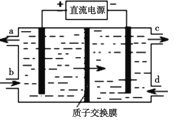
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图所示。其阴极的电极反应式为 :______。
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3。装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2____L(用含a、b的代数式表示)。
【答案】1.5×10-4② 3:1 NH3与NO的物质的量比值越大,NO的脱除率越大 4NH3(g) + 6NO(g)=5N2(g) +6H2O(1)△H=-(3Q2+3Q3-2Q1)kJ/mol 3Ce4++NO+2H2O=3Ce3+NO3-+ 4H+ 2HSO3-+2e-+2H+=S2O42-+2H2O 5.6(3b-a)
【解析】
Ⅰ.(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,NO的浓度变化为6×10-4mg/m3(0.75-0.55)= 1.2×10-4mg/m3,该时间段内NO的脱除速率为1.5×10-4mg/(m3·s),故答案为:1.5×10-4;
②当其他条件相同时,NH3与NO的物质的量比值越大,NO的脱除率越大,故NH3与NO的物质的量之比分别为1:3、3:l、4:1时,对应的曲线分别为c、b、a,则曲线b对应的NH3与NO的物质的量之比是3:1,其理由是NH3与NO的物质的量比值越大,NO的脱除率越大,故答案为:3:1;NH3与NO的物质的量比值越大,NO的脱除率越大;
(2)已知在25℃,101kPa时,①N2(g)+3H2(g) =2NH3(g) △H=-Q1kJ/mol;②2H2(g)+O2(g) =2H2O(1) △H=- Q2kJ/mo1;③N2(g) +O2(g) = 2NO(g) △H=+ Q3kJ/mo1,根据盖斯定律:②×3+③×3-①×2得用NH3脱除NO的热化学方程式为4 NH3(g) + 6 NO(g) ==5 N2(g) +6 H2O(1) △H=-(3Q2+3Q3-2Q1)kJ/mol,故答案为:4NH3(g) + 6NO(g)=5N2(g) +6H2O(1)△H=-(3Q2+3Q3-2Q1)kJ/mol;
Ⅱ.(3)根据化学工艺流程知装置Ⅱ中NO与Ce4+反应生成NO3-、NO2—和Ce3+,反应的离子方程式为3Ce4++NO+2H2O=3Ce3+NO3-+ 4H+,故答案为:3Ce4++NO+2H2O=3Ce3+NO3-+ 4H+;
(4)装置Ⅲ为电解池,Ce4+再生,发生氧化反应Ce3+-e-=Ce4+,为电解池的阳极反应,则阴极反应为HSO3-被还原为S2O42-,电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+=S2O42-+2H2O;
(5)按上述流程处理;amolSO2转化为Na2S2O4得到amol电子,bmolNO转化为NH4NO3失去3bmol电子。根据电子守恒知O2得电子的物质的量为(3b-a)mol,则通入氧气的物质的量为(3b-a)/4mol,,标准状况下的体积为5.6(3b-a)L,故答案为:5.6(3b-a)。


科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验

下列叙述中不正确的是
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1实验中反应速率为a>b,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好
C.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
D.图2中关闭A处活塞,将针筒活塞向外拉,松开后针筒活塞复原说明装置气密性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
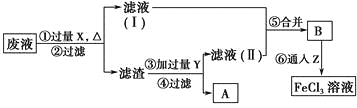
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活关系密切。下列有关说法错误的是( )
A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物
B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一
C.“玉兔二号”月球车使用的帆板太阳能电池的材料是![]()
D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com