
| 价层电子排布 | 周期 | 族 | 周期表所属区 |
| 5 | VIA | ||
| 6s1 | |||
| 4d55s1 | |||
| 6 | ⅡB |
| 价层电子排布 | 周期 | 族 | 周期表所属区 |
| 4s25p1 | 5 | VIA | p |
| 6s1 | 6 | ⅠA | s |
| 4d55s1 | 5 | ⅥB | d |
| 4d55s2 | 6 | ⅡB | ds |


科目:高中化学 来源: 题型:
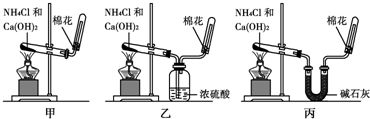
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在所有元素中,氟的电离能最大 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、第3周期所含的元素中钠的第一电离能最小 |
| D、钾的第一电离能比镁的第一电离能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④⑤ |
| C、③⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质均为双原子分子 |
| B、均为非金属元素 |
| C、原子最外层电子数相同,均为7个 |
| D、原子核外电子层数依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减气空气进入量或增大天然气的进入量 |
| B、增大空气进入量或减小天然气的进入量 |
| C、减小空气进入量,同时减小天然气的进入量 |
| D、增大空气进入量,同时增大天然气的进入量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com