
| A、①② | B、③④⑤ |
| C、③⑤ | D、①③④ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

A、 、HCHO和 、HCHO和 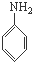 |
B、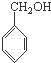 、CH3OH和 、CH3OH和 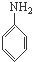 |
C、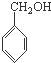 、HCHO和 、HCHO和 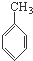 |
D、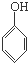 、CH3CHO和 、CH3CHO和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
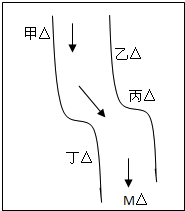 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com