
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):| 35% | ||
|
| 8×22.4L×106g |
| 480g |
| 13.2mol |
| 20% |
| 8mol |
| 63mol |
| 480g |
| 120g/mol |
| 1 |
| 5 |
| 1 |
| 5 |
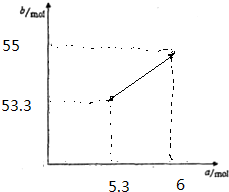 故答案为:
故答案为: .
.


科目:高中化学 来源: 题型:
| A、完全电解2molH2O断裂的σ键键数为4NA |
| B、标准状况下,11.2LCO2中含有的π键键数为2 NA |
| C、60gSiO2晶体中含有的Si-O键键数为4NA |
| D、12g金刚石中含有C-C键键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在所有元素中,氟的电离能最大 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、第3周期所含的元素中钠的第一电离能最小 |
| D、钾的第一电离能比镁的第一电离能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④⑤ |
| C、③⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A、正反应是吸热反应 |
| B、恒温时增大压强,正反应速率增大 |
| C、830℃时,反应达到平衡,c(CO)=c(CO2) |
| D、400℃时,恒容反应器中投入CO、H2O、H2、CO2物质的量分别为5 mol、1 mol、2 mol、3mol,反应向逆方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com