
| n |
| V |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | ||
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | ||
D、SO2(g)+2CO(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 特征信息 |
| A | 其中一种原子核内只有质子没有中子 |
| B | 其原子的L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
| D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
| E | 单质为黄绿色气体,可用于制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:

A、 、HCHO和 、HCHO和 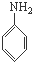 |
B、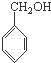 、CH3OH和 、CH3OH和 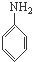 |
C、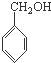 、HCHO和 、HCHO和 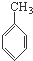 |
D、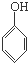 、CH3CHO和 、CH3CHO和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
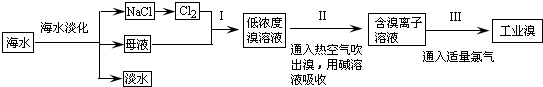
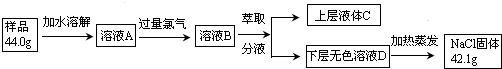
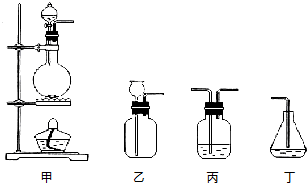
查看答案和解析>>
科目:高中化学 来源: 题型:
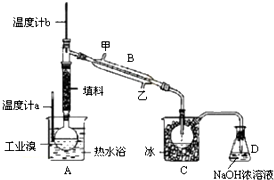
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 mol?L-1 | K1=4.3×10-7 mol?L-1 K2=5.6×10-11 mol?L-1 | K1=9.1×10-8 mol?L-1 K2=1.1×10-12 mol?L-1 | K1=7.5×10-3 mol?L-1 K2=6.2×10-8 mol?L-1 K3=2.2×10-13 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com