
| 元素编号 | 特征信息 |
| A | 其中一种原子核内只有质子没有中子 |
| B | 其原子的L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
| D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
| E | 单质为黄绿色气体,可用于制造漂白粉 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、加热条件下均能与碳反应 |
| B、长期露置在空气中浓度均会降低 |
| C、常温下均不能用铁制容器贮存 |
| D、一定条件下均可与铜片反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 与CO2反应,产生O2 | |
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
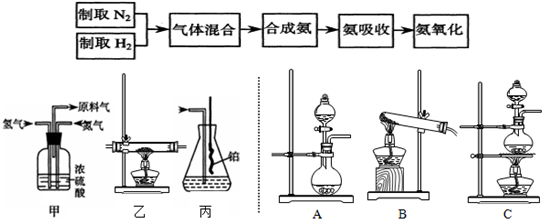
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、完全电解2molH2O断裂的σ键键数为4NA |
| B、标准状况下,11.2LCO2中含有的π键键数为2 NA |
| C、60gSiO2晶体中含有的Si-O键键数为4NA |
| D、12g金刚石中含有C-C键键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
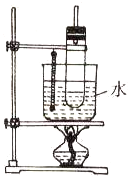 实验室制取硝基苯常用如图装置:
实验室制取硝基苯常用如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
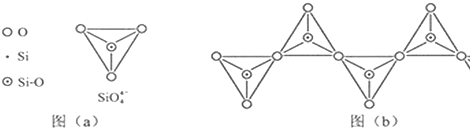
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com