
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | ||
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | ||
D、SO2(g)+2CO(g)
|


科目:高中化学 来源: 题型:
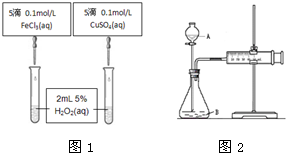
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热条件下均能与碳反应 |
| B、长期露置在空气中浓度均会降低 |
| C、常温下均不能用铁制容器贮存 |
| D、一定条件下均可与铜片反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、(a+3b)mol | ||
C、
| ||
| D、(cV-3a-9b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属原子失电子越多,其还原性越强 |
| B、CH4的摩尔质量为16g |
| C、10g质量分数为98%的H2SO4,用水稀释至100g,H2SO4的质量分数为9.8% |
| D、电解质物质本身一定导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 与CO2反应,产生O2 | |
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
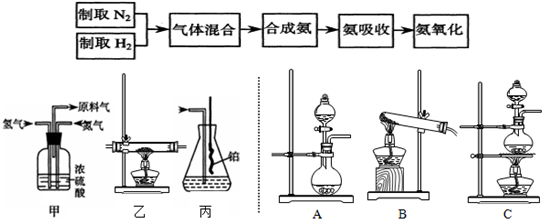
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com