
| A、金属原子失电子越多,其还原性越强 |
| B、CH4的摩尔质量为16g |
| C、10g质量分数为98%的H2SO4,用水稀释至100g,H2SO4的质量分数为9.8% |
| D、电解质物质本身一定导电 |


科目:高中化学 来源: 题型:
| A、杜绝污染源 |
| B、减少有害物质 |
| C、治理污染点 |
| D、处理废弃物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
| B、NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-═NH3↑+2H2O |
| C、向1L 1mol/L碘化亚铁溶液中通入标准状况下22.4L氯气:2Fe2+-+Cl2═2Fe3+2Cl- |
| D、澄清石灰水与少量的小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O体积/mL | ||
| 体积/mL | 浓度/(mol?L-1) | 体积/mL | 浓度/(mol?L-1) | |||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | ||
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | ||
D、SO2(g)+2CO(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)1.7g NH3共有
(1)1.7g NH3共有查看答案和解析>>
科目:高中化学 来源: 题型:
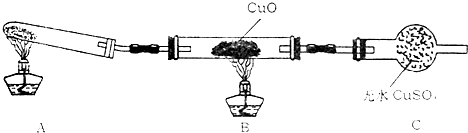
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
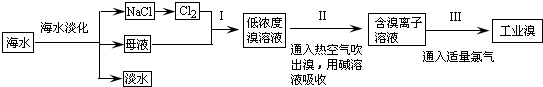
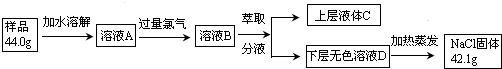
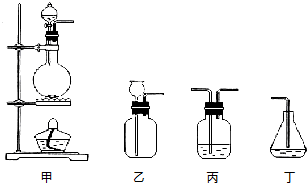
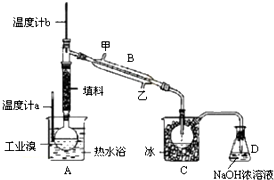
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com