
 (1)1.7g NH3共有
(1)1.7g NH3共有| m |
| M |
| N |
| NA |
| V |
| Vm |
| m |
| n |
| 1000ρω |
| M |
| 1.7g |
| 17g/mol |
| 1 |
| 17 |
| 1 |
| 16 |
| 1.2g |
| 0.001ml |
| 12.5g |
| 5% |
| 250g |
| 250mL |
| 1000×1g/L×5% |
| 180g/mol |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
 ,若要检验出其中的碳碳双键,其方法是
,若要检验出其中的碳碳双键,其方法是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属原子失电子越多,其还原性越强 |
| B、CH4的摩尔质量为16g |
| C、10g质量分数为98%的H2SO4,用水稀释至100g,H2SO4的质量分数为9.8% |
| D、电解质物质本身一定导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | ||||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
C、葡萄糖与菲林试剂的反应:CH2OH(CHOH)4CHO+2Cu(OH)2+OH-
| ||||
D、苯酚钠溶液中通入少量CO2:CO2+H2O+ → → +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

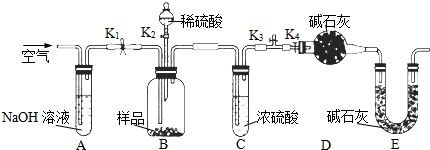
| 仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 与CO2反应,产生O2 | |
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com