
 现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:
现有一盛有常见固体物质M的试剂瓶,标签已破损(如图所示).请根据其性质回答下列问题:

科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.02g |
| B、8.51g |
| C、8.00g |
| D、7.04g |
查看答案和解析>>
科目:高中化学 来源: 题型:
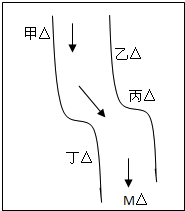 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:3s23p1 Y:3s23p5 |
| B、X:2s22p3 Y:2s22p5 |
| C、X:3s23p1 Y:3s23p4 |
| D、X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是利用化学原理治理环境污染 |
| B、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C、大量使用风能、太阳能、生物质能,符合“低碳”理念 |
| D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com