
相同温度下,根据三种酸的电离常数,下列判断正确的是
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
科目:高中化学 来源: 题型:
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是
A.正是氢键的存在,冰能浮在水面上
B.氢键是自然界中最重要、存在最广泛的化学键之一
C.由于氢键的存在,沸点:HCl>HBr>HI>HF
D.由于氢键的存在,水分子变的更稳定了
查看答案和解析>>
科目:高中化学 来源: 题型:
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
|
| 活性炭 | NO | E | F | ||||||||
| 初始 | 2.030 | 0.100 | 0 | 0 | ||||||||
| T1 | 2.000 | 0.040 | 0.030 | 0.030 | ||||||||
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:________________ ________________________________________________________。
________________________________________________________。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1=________。
②根据上述信息判断,T1和T2的关系是________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
科目:高中化学 来源: 题型:
下列可以说明乙酸是弱酸的事实是
A.乙酸不能使酚酞溶液变红色
B.乙酸能使紫色石蕊试液变红色
C.乙酸和Na2CO3反应可放出CO2
D.0.1 mol·L-1的乙酸溶液pH>1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能证明HNO2是弱电解质的是
①滴入酚酞,NaNO2溶液显红色 ②用HNO2溶液做导电实验,灯泡很暗 ③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强 ④0.1 mol·L-1HNO2溶液的pH=2 ⑤HNO2与CaCO3反应放出CO2气体 ⑥c(H+)=0.1 mol·L-1的HNO2溶液稀释至1 000倍,pH<4
A.①⑤ B.②⑤
C.③⑥ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________________________________
(填“正”或“逆”)反应方向移动,理由是_______________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向____________(填“正”或“逆”)反应方向移动,溶液中c(A-)将________(填“增大”“减小”或“不变”),溶液中c(OH-)将________(填“增大”“减小”或“不变”)。
(3)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH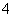 )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________________。
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关试剂的保存方法,错误的是( )
A.为防止水解,FeCl3溶液中加入少量稀硫酸
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室有一瓶失去标签的某白色固体X,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一。现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象:________________________________________________________。
结论:此白色固体是钠盐。
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤Ⅰ 称取样品1.000 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤Ⅲ所发生反应的离子方程式_____________________________________
________________________________________________________________________。
(2)在配制0.01 mol·L-1KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量________(填“偏大”、“偏小”或“无影响”)。
(3)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com