
科目: 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(燃烧热) | |
| B. | 2S(s)+2O2(g)═2SO2(g);△H=-269.8kJ/mol(燃烧热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
查看答案和解析>>
科目: 来源: 题型:实验题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目: 来源: 题型:实验题
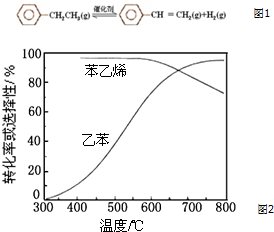 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
科目: 来源: 题型:实验题
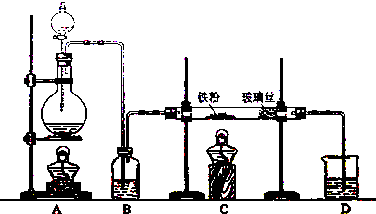
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)?2CO(g)△H=a kJ/mol不能自发进行,则该反应的a<0 | |
| B. | 已知中和热△H为-57.3kJ/mol,则稀醋酸与0.1 mol/L NaOH溶液反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热△H为-241.8 kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成17.6g硫化亚铁时,放出19.12kJ热量.该反应的热化学方程式可表示为Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com