
科目: 来源: 题型:解答题
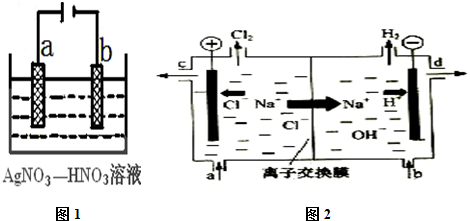
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质(杂质) | 除杂试剂 | |
| A | NaHCO3(Na2CO3) | 稀盐酸 |
| B | CO2(HCl) | 饱和碳酸钠溶液 |
| C | NH3(H2O) | 浓硫酸 |
| D | Fe3+(Fe2+) | 过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| a(干燥气体) | b(液体) | 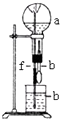 | |
| A | Cl2 | 饱和食盐水 | |
| B | NO+O2(物质的量之比为4:1) | H2O | |
| C | CO2 | NaOH | |
| D | NO2 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 定容时仰视液面 | |
| B. | 溶解后立即转移到容量瓶中 | |
| C. | 未洗涤烧杯和玻璃棒 | |
| D. | 溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱烘干 | |
| B. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 | |
| C. | 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 | |
| D. | 酸式滴定管装标准溶液前,必须先用标准溶液润洗 |
查看答案和解析>>
科目: 来源: 题型:解答题
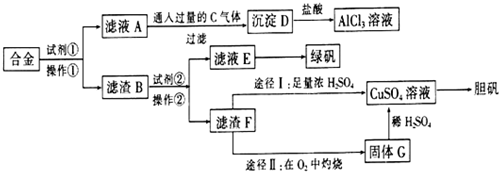
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某无色溶液可大量存在:H+、Cl-、MnO4- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中可能存在:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 与Al反应能放出H2的溶液中可大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 氢氧化钙溶液中可大量存在:Na+、ClO-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com