
科目: 来源: 题型:解答题
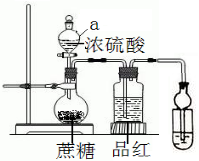 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
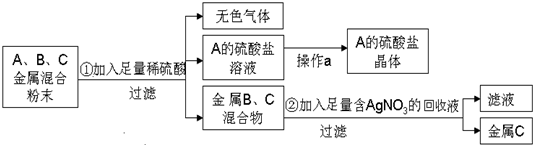
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氨水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
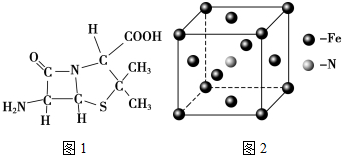
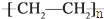 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目: 来源: 题型:实验题
| 组成物质分别是 | |||||
| 质 量 为(g) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2O3 | B. | NO2 | C. | N2O | D. | N2O4 |
查看答案和解析>>
科目: 来源: 题型:解答题
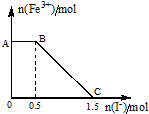 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮查看答案和解析>>
科目: 来源: 题型:解答题
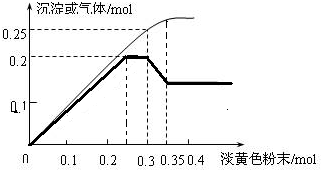 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com