
科目: 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,通入CO后,正反应速率逐渐增大 | |
| C. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| D. | 对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,只改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
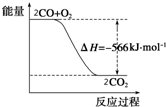 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d | |
| B. | 若反应开始容器中只有A和B,平衡时,A、B的转化率相等,则A、B的物质的量之比为1:1 | |
| C. | 若平衡体系中共有气体xmol,再向其中充入bmolB,达到平衡时气体总物质的量为(x+b)mol,则a+b=c+d | |
| D. | 若a+b=c+d,升高温度时,A的体积分数不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 | |
| B. | 正反应是吸热反应,达到平衡时,升高温度,v正增大,v逆减小,所以平衡向正反应方向移动 | |
| C. | 一定条件下增大反应物的量,一定会加快反应速率 | |
| D. | 对于任何一个化学反应,用其中任何一种反应物浓度的减小来表示化学反应速率,都是相同的数值 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com