
科目: 来源: 题型:选择题
| A. | 物质的量浓度c(甲)=10c(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度和乙的相等 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲) | |
| D. | 甲中的c(OH-)为乙中c(OH-)的10倍 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
查看答案和解析>>
科目: 来源: 题型:实验题
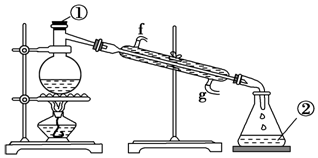
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | 标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
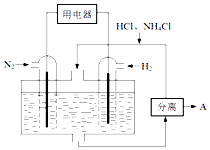 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com