
科目: 来源: 题型:

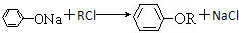








 ),反应的化学方程式是:第一步:
),反应的化学方程式是:第一步:



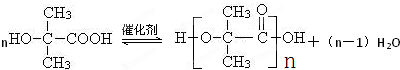
 结构).
结构).查看答案和解析>>
科目: 来源: 题型:阅读理解
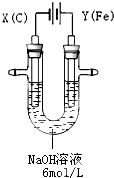 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.| 充电 | 放电 |
查看答案和解析>>
科目: 来源: 题型:
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) (已折算为标况) |
耗时(s) | 化学式 | 质量(g) | 实际回收 | 1 | 0.6 | - | - | - | 10 | 480 | 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 | 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 | 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 | 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
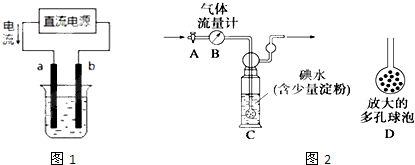
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
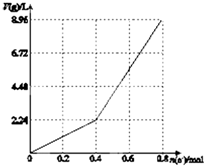 以石墨电极电解200mL CuSO4溶液,电解过程中产生气体体积V(g)(标准状况)与电子转移物质的量n(e-)的关系如图所示,n(e-)=0.8mol时停止电解.下列说法中正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中产生气体体积V(g)(标准状况)与电子转移物质的量n(e-)的关系如图所示,n(e-)=0.8mol时停止电解.下列说法中正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com