
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (2011?龙岩模拟)某溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L).现用碱调节溶液pH,根据表可知,下列说法错误的是( )
(2011?龙岩模拟)某溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L).现用碱调节溶液pH,根据表可知,下列说法错误的是( )查看答案和解析>>
科目: 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② 分别投入大小、形状相同的铜、铁、镁 分别投入大小、形状相同的铜、铁、镁 |
反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目: 来源: 题型:
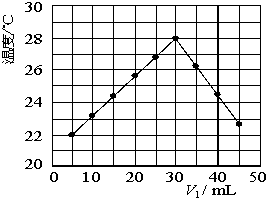 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:| 3 |
| 2 |
| 3 |
| 2 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com