
科目: 来源: 题型:
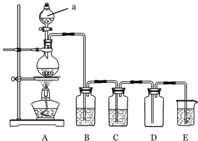 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解

| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
| 7 |
| 8 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com