
科目: 来源: 题型:选择题
| 温度 | Pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
| A. |  | B. |  | C. | 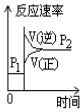 | D. |  |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol•L-1的NaClO 溶液中含有ClO-的数目小于NA | |
| B. | 1.5 g甲醛和乙酸的混合物中原子总数为0.2NA | |
| C. | 氯气与足量铁反应得到的电子数一定为2NA | |
| D. | 104g苯乙烯中含有的碳碳双键个数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别是蛋白质和高级烃 | |
| B. | 可用  和HCHO为原料合成 和HCHO为原料合成 | |
| C. | 漂白粉因主要成分是CaCl2故暴露在空气中不易变质 | |
| D. | 按照分散质和分散剂所处状态的不同可以把分散系分为9种类型 |
查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )| A. | 曲线上任意一点均存在:c(H+)+c(Na+)═c(OH-)+c(Y2-)+c(HY-) | |
| B. | c(Na+)=0.10 mol•L-1时,溶液中的c(H+)+c(H2Y)═c(OH-)+c(Y2-) | |
| C. | 由图可知,H2Y为二元弱酸,如果将物质的量浓度均为0.20mol•L-1的NaHY和Na2Y溶液等体积混合,所得溶液的pH=4.2 | |
| D. | 已知25℃时,HCOOH的Ka=1×10-4.若把少量H2Y加入到HCOONa溶液中,发生的离子反应可表示为:H2Y+2HCOO-═2HCOOH+Y2- |
查看答案和解析>>
科目: 来源: 题型:解答题
 法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
| NH3 | PH3 | AsH3 | SbH3 | |
| 熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
| 沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| N≡N | H-H | N-H | |
| 键能数据(KJ/mol) | 946 | 436 | x |


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镀锡的铁制品,镀层部分受损后,露出的铁表面不易被腐蚀 | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下浓硫酸与铝不反应,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 常温下二氧化硅不与任何酸反应,可用石英容器盛放氢氟酸 | |
| C. | 铝热反应原理是炼铁最常用的反应原理 | |
| D. | 氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeCl2 | |
| B. | Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 | |
| C. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com