
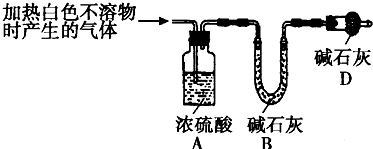
科目: 来源: 题型:阅读理解
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成为 ①氢气 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤, 加入足量 ②稀盐酸 ②稀盐酸 |
③产生气体沉淀全部溶解 ③产生气体沉淀全部溶解 |
白色不溶物可能是MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清溶液, 向其中加入少量稀CaCl2溶液 |
产生白色沉淀 | 溶液中存在 ④CO32- ④CO32- |
查看答案和解析>>
科目: 来源: 题型:

| O | - 3 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
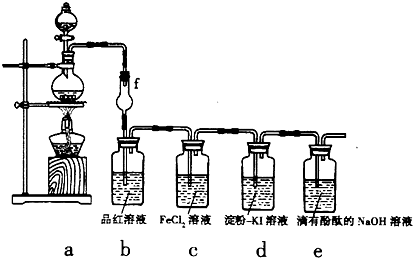
| O | 2- 4 |
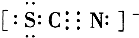 ;
;| O | 2- 4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
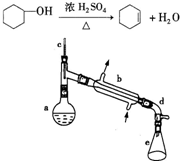 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |


查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
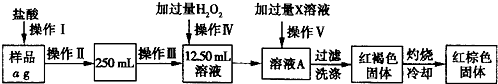
| 14(w2-w1) |
| a |
| 14(w2-w1) |
| a |
查看答案和解析>>
科目: 来源: 题型:阅读理解
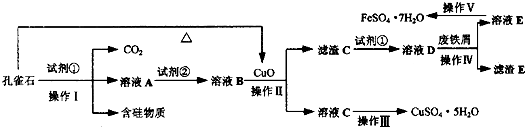
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com