
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
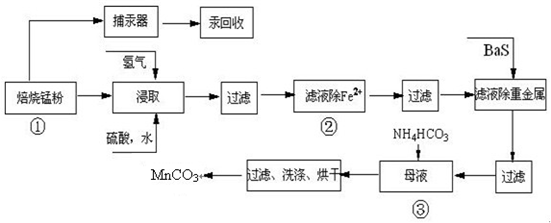
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到 3.7~8.6 3.7~8.6 ,使Fe3+沉淀完全 |
Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
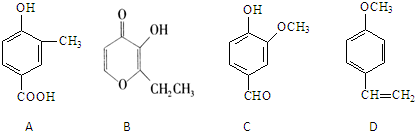
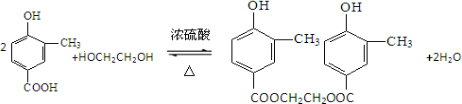

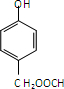

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com