
科目: 来源: 题型:选择题
| A. | 全部 | B. | ①③④ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,17g氨气分子所含质子数为10NA | |
| B. | 1mol CL2参加反应,转移电子数一定为2N | |
| C. | 常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA个CO2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
查看答案和解析>>
科目: 来源: 题型:解答题
 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
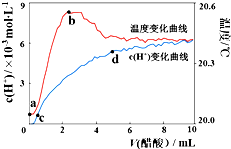 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用于生产矸石水泥、耐火砖等建筑材料 | |
| B. | 煤矸石中的金属氧化物均为碱性氧化物 | |
| C. | P2O5和SO3对应水化物的酸性较强的是 H3PO4 | |
| D. | 铝比镓活泼,能电解GaCl3水溶液制备镓单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com