
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
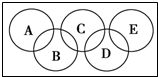 焰色反应是化学上用来测定某种金属是否存在于化合物的方法.
焰色反应是化学上用来测定某种金属是否存在于化合物的方法.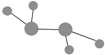 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 结构简式为 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 | |
| B. | 分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 | |
| C. | 某有机物球棍结构模型为: ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 | |
| D. | 二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:选择题
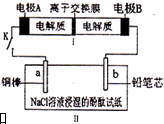 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 负极反应为2S22--2e-=S42- | |
| B. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出气体112 mL | |
| C. | 闭合K后,b电极附近的pH变小 | |
| D. | 闭合K后,a电极上有气体产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 | |
| D. | 某密闭容器盛有0.1molN2,0.3molH2,在一定条件下反应,转移的电子数为0.6NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com