
科目: 来源: 题型:解答题
 .其基态原子有26种能量不同的电子;
.其基态原子有26种能量不同的电子;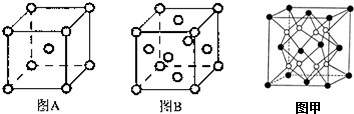
查看答案和解析>>
科目: 来源: 题型:解答题
| X | ||
| M |
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;查看答案和解析>>
科目: 来源: 题型:选择题
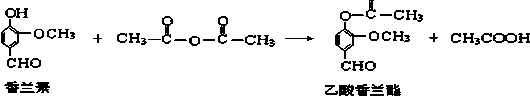
| A. | 该反应属于加成反应 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 乙酸香兰酯的分子式为C10H8O4 | |
| D. | 乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2mol | B. | 2.5 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
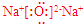
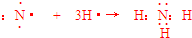 .
.查看答案和解析>>
科目: 来源: 题型:填空题
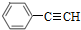 的合成方法有:
的合成方法有: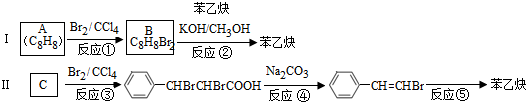

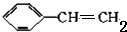 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.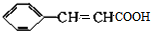 ,反应⑤的化学方程式为
,反应⑤的化学方程式为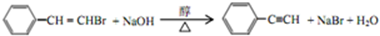 (注明反应条件)
(注明反应条件)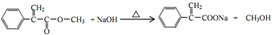 .
.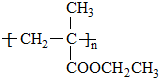 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.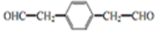 .
.查看答案和解析>>
科目: 来源: 题型:填空题
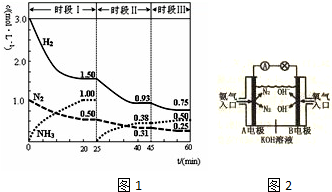
查看答案和解析>>
科目: 来源: 题型:填空题
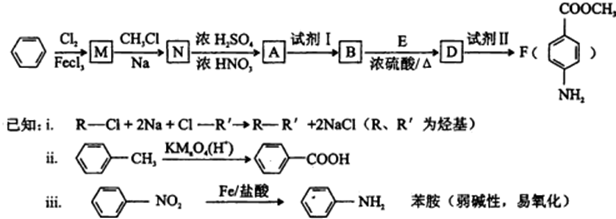
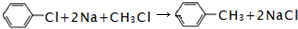 .
.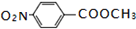 .
. ;
;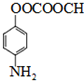 .
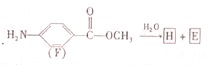
.
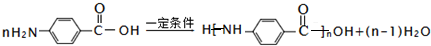 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com