
科目: 来源: 题型:解答题
 由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
查看答案和解析>>
科目: 来源: 题型:解答题
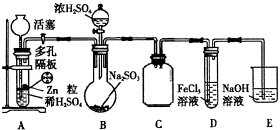
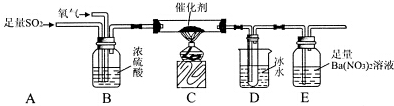
查看答案和解析>>
科目: 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Fe | 稀盐酸 | 偏向Fe |
| 2 | Fe、Cu | CuSO4溶液 | 偏向Cu |
| 3 | Fe、石墨 | 稀盐酸 | ? |
查看答案和解析>>
科目: 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
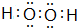 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
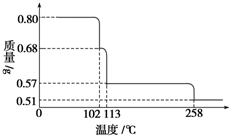 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com