
科目: 来源: 题型:选择题
| A. | 可以用新制氢氧化铜鉴别③与④ | B. | ①、②、③均能与金属钠反应 | ||
| C. | ①、②、③均能发生取代反应 | D. | 一定条件下,④可以转化为② |
查看答案和解析>>
科目: 来源: 题型:解答题
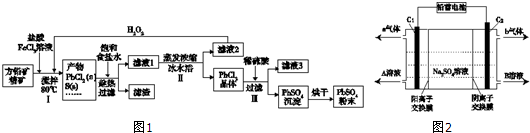
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
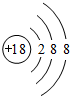 ;最活泼的非金属元素的离子结构示意图
;最活泼的非金属元素的离子结构示意图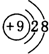 ;最活泼金属元素过氧化物的电子式
;最活泼金属元素过氧化物的电子式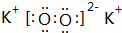 ,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.
,指出其中的化学键类型离子键、共价键;①的最高价氧化物的结构式O=C=O.| 实验步骤 | 实验现象与结论 |
| 向H2S溶液中通入O2 | 溶液出现浑浊,说明O2的氧化性比S强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2b+n-8ROb | B. | HnROb | C. | H8-nROb | D. | H2b-n-8ROb |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com