
科目: 来源: 题型:选择题
| A. | “类钫”属过渡元素,具有放射性 | B. | “类钫”可与水剧烈反应 | ||
| C. | “类钫”单质的密度小于1g/cm3 | D. | “类钫”单质有较高熔点 |
查看答案和解析>>
科目: 来源: 题型:解答题
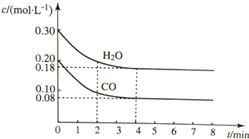 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子组成中相差一个或几个CH2 原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构不同的有机物不一定是同分异构体 | |
| D. | 互为同系物的有机物其分子结构必然相似 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com