
科目: 来源: 题型:
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
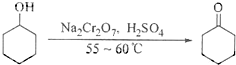
| 物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
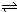 N2O4(g)达到平衡.
N2O4(g)达到平衡.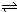 N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.查看答案和解析>>
科目: 来源: 题型:
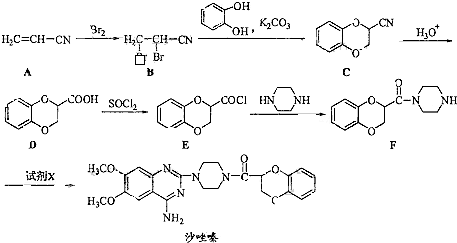
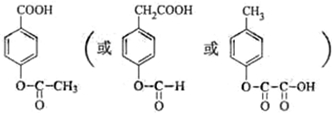

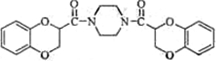

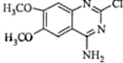

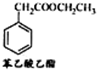
| ||
| 170℃ |
| Br2 |
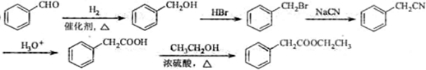

查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.| c(V2-4V1) |
| 4V |
| c(V2-4V1) |
| 4V |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com