
科目: 来源: 题型:多选题
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的稳定性逐渐增强 | ||
| C. | 单质的熔点逐渐升高 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
 ,违背了泡利原理.
,违背了泡利原理.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 族 | IA | 0 | ||||||
| 1 | ① | IIA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 核内无中子的原子 | |
| B. | 价电子构型为3s23p1 | |
| C. | 最外层电子数等于倒数第三层上的电子数的原子 | |
| D. | N层上无电子,最外层上的电子数等于电子层数的原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
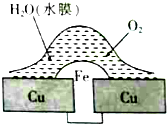
| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯铜作阳极 | |
| B. | 阴极发生氧化反应 | |
| C. | 电解后后c(Cu2+)保持不变 | |
| D. | 电解槽底部会生成含有Ag、Pt的阳极泥 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. |  | C. | 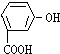 | D. | 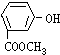 |
查看答案和解析>>
科目: 来源: 题型:填空题
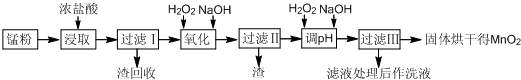
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
 一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
一定温度下,两个体积相等的连通容器用活塞分开,左右两室各充入一定量NO和O2,恰好使两容器内气体密度相同,打开活塞,充分混合反应.下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 最终容器内无O2存在 | B. | 反应前、后左室气体压强不变 | ||
| C. | 反应前、后右室气体密度不变 | D. | 开始时左右两室气体分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com