
科目: 来源: 题型:选择题
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则列说法不正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则列说法不正确的是( )| A. | A、B两种酸溶液物质的量浓度相等 | B. | 稀释后A酸溶液的酸性比B酸溶液弱 | ||
| C. | 若A=5时,A是强酸,B是弱酸 | D. | 若5>a>2,则A、B都是弱酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨水能跟H2SO4反应生成(NH4)2SO4 | B. | 铵盐受热易分解 | ||
| C. | 0.1mol/L的氨水可使酚酞试液变红 | D. | 25℃,0.1mol/L氨水的pH约为12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) | B. | H2O+H2O=H3O++OH- | ||
| C. | NH3.H2O(aq)=NH3(g)+H2O(1) | D. | Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目: 来源: 题型:解答题
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 苯与混酸制备硝基苯 | 乙酸、乙醇及浓硫酸制备乙酸乙酯 | 溴乙烷与氢氧化钠溶液加热 | 制备TNT |
| 加成反应 | 取代反应 | 消去反应 | 酯化反应 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题

 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
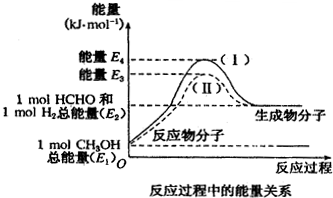
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com