
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
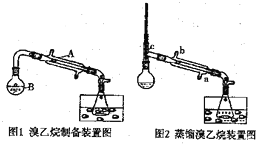
查看答案和解析>>
科目: 来源: 题型:解答题


| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中加入少量BaCl2溶液. (或取试管B中溶液做焰色反应实验). | 不产生白色沉淀(或焰色不呈黄色) | 产品中不含 Na2SO4 |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目: 来源: 题型:解答题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 气体通过盛有足量溴水的洗气瓶 | |
| C. | 气体通过盛有足量蒸馏水的洗气瓶 | |
| D. | 气体与适量HCl混合 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ⑤②①③④ | D. | ④①②⑤③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最简式为CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com