
科目: 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 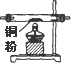 |  |  |  | 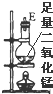 |  |
查看答案和解析>>
科目: 来源: 题型:填空题
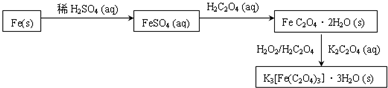
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
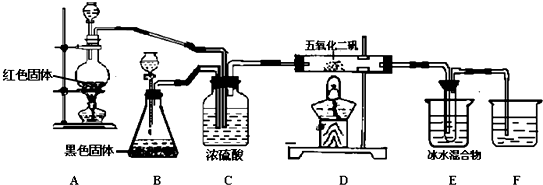
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com