
科目: 来源: 题型:多选题
| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
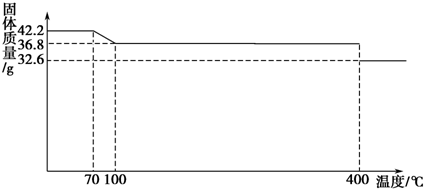
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸氢钠的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | |
| B. | 用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ | |
| C. | 硫化钠水解的离子方程式:S2-+2H2O═H2S+2OH- | |
| D. | 用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O(过量)?TiO2•x H2O↓+4HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| C. | 两溶液中由水电离出的c(OH-)之比为10-9/10-5 | |
| D. | 分别与同浓度的盐酸反应,pH=7时消耗的盐酸体积相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
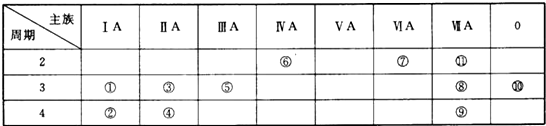

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com