有几个实验小组的同学,利用如图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢慢滴下;b中盛放的药品足量;若在c、d中盛放液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.请你回答以下各组同学在交流实验设计方案中提出的问题:
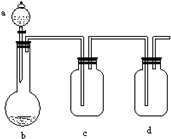
Ⅰ(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧
化锰强得多);c:左侧放干燥红布条,右侧放红色鲜花瓣.在实验过程中c中现象能说明
具有漂白性的是次氯酸而不是氯气
具有漂白性的是次氯酸而不是氯气
.
d装置中盛放药品的作用是
吸收未反应的氯气,防止环境污染
吸收未反应的氯气,防止环境污染
,请写出d中反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(2)若a:稀盐酸;b:贝壳粉;c:饱和碳酸钠溶液;d:饱和苯酚钠溶液.在实验过程中,c中出现的现象是
有晶体析出
有晶体析出
.d中现象是
出现浑浊
出现浑浊
,这说明
苯酚的酸性弱于碳酸
苯酚的酸性弱于碳酸
.
(3)若a:饱和食盐水;b:碳化钙;c:少量酸性高锰酸钾溶液;d:溴水.在实验过程中,c中出现的现象说明生成的气体具有
还原
还原
性.d中发生反应的类型是
加成
加成
.多余气体处理方法是
点燃
点燃
.
(4)若a:浓氨水;b:生石灰;c:四氯化碳;d:盐酸.在实验过程中,c中出现的现象是
冒气泡,接着d中物质回流到c中,液体分层,下层为油状物.
冒气泡,接着d中物质回流到c中,液体分层,下层为油状物.
.写出d中反应的离子方程式:
NH3+H+=NH4+
NH3+H+=NH4+
Ⅱ你认为四组同学在制取气体之前都应该进行的操作是
气密性检查
气密性检查
.你还可以利用此装置的a和b两部分还可以制取的气体有(只写一种)
氧气(或二氧化硫、氢气)
氧气(或二氧化硫、氢气)
.

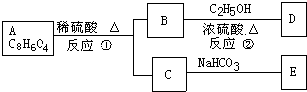
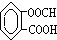
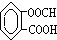
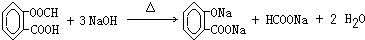

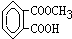 、
、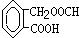 、
、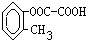 、
、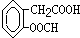
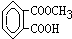 、
、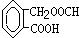 、
、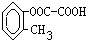 、
、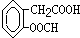
 、
、
 、
、


 Ⅰ(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧
Ⅰ(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧